Онкология
-
ДЕКАПЕПТИЛ ДЕПО
ДЕКАПЕПТИЛ ДЕПО
(трипторелина ацетат)
(трипторелина ацетат)
Онкология - симптомный эндометриоз, подтвержденный лапароскопией, при отсутствии показаний к оперативному лечению и наличии показаний к подавлению функции яичников;
- симптомная миома матки (лейомиома, фибромиома) перед оперативным вмешательством, с целью уменьшения объема кровотечения и болевого синдрома;
- профилактика преждевременного повышения концентрации ЛГ при проведении контролируемой стимуляции яичников с использованием вспомогательных репродуктивных технологий (ВРТ).
- гормонозависимый местно распространенный или метастатический рак предстательной железы.
- преждевременное половое созревание центрального генеза (у девочек до 9 лет и мальчиков до 10 лет).
- гиперчувствительность к трипторелину, другим аналогам ГнРГ и/или любым вспомогательным веществам в составе препарата или растворителя;
- возраст до 18 лет (за исключением показания к применению при преждевременном половом созревании).
- беременность;
- период грудного вскармливания.
- подростковый возраст (у мальчиков старше 13 лет, у девочек старше 12 лет).
- остеопороз или высокий риск его развития;
- депрессия в анамнезе;
- у женщин при выполнении программы ВРТ - синдром поликистозных яичников (СПКЯ);
- у мужчин с наличием в анамнезе эпизодов удлинения интервала QT или соответствующими факторами риска, а также у мужчин, получающих лекарственные препараты, способные удлинять интервал QT;
- у детей с преждевременным половым созреванием центрального генеза с прогрессирующей опухолью головного мозга.
- Препарат Декапептил депо следует хранить в оригинальной упаковке в холодильнике.
- После восстановления суспензию следует ввести в течение 3 минут после разведения.
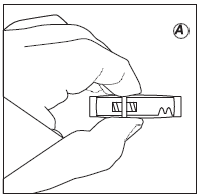
- Подготовка
- Извлечь упаковку препарата Декапептил депо из холодильника.
- Вскрыть упаковку с соединительным элементом и извлечь соединительный элемент.
- Снять колпачок со шприца с порошком. Шприц следует держать строго вертикально концом вверх во избежание высыпания микрокапсул порошка.
- Навинтить шприц с порошком на соединительный элемент до упора резьбы соединительного элемента.
- Снять колпачок со шприца с растворителем. Шприц следует держать строго вертикально концом вверх во избежание проливания растворителя.
- Навинтить шприц с растворителем на свободный край соединительного элемента до упора резьбы соединительного элемента.
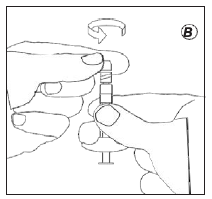
- Восстановление суспензии
- Перегнать весь растворитель в шприц с порошком.
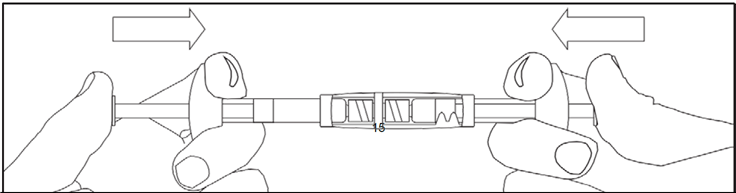
- Смесь следует перегонять между двумя шприцами до образования гомогенной суспензии от молочно-белого до светло-желтого цвета. Шприц следует держать, не наклонять.
- Суспензия должна находиться в шприце, который присоединен к соединительному элементу со стороны без указателей дозы.
- Повернуть шприцы в вертикальное положение, при этом шприц с суспензией должен быть сверху.
- Подождать несколько секунд до отделения пены.
- Медленно потянуть шток поршня пустого шприца вниз, пока суспензия не достигнет отметки «1/2» или «2/3».
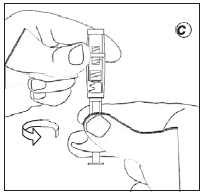
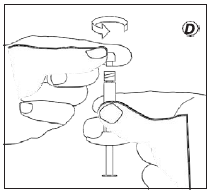
- Введение препарата
- Отсоединить шприц с суспензией от соединительного элемента.
- Навинтить на шприц иглу для инъекций.
- Ввести суспензию в течение 3 минут.
-
ФИРМАГОН
ФИРМАГОН
(дегареликс)
(дегареликс)
Онкология - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
- 31 % был диагностирован локализованный рак предстательной железы;
- 29 % – местно распространенный рак предстательной железы;
- 20 % – метастатический рак предстательной железы;
- 7 % – неустановленный метастатический статус;
- у 13 % пациентов повышение ПСА отмечалось после выполнения радикального хирургического вмешательства или лучевой терапии.
- для группы, получавшей дегареликс 240 мг/80 мг: 19,8 нг/мл (интерквартильный размах P25 9,4 нг/мл, P75 46,4 нг/мл);
- для группы, получавшей лейпрорелин 7,5 мг: 17,4 нг/мл (интерквартильный размах P25 8,4 нг/мл, P75 56,5 нг/мл).
- ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
- Снять защитный колпачок с флакона с лиофилизатом. Плотно надеть переходник на флакон, острый конец переходника должен проколоть резиновую пробку флакона, зафиксировав переходник.
- Приготовить предварительно заполненный шприц с растворителем, присоединив шток поршня.
- Снять защитный колпачок со шприца с растворителем. Присоединить шприц к флакону с лиофилизатом путем навинчивания на переходник. Медленно ввести весь объем растворителя во флакон.
- Не снимая шприц с переходника, круговыми движениями аккуратно перемешать содержимое флакона до получения прозрачного раствора. Наличие нерастворенных частиц не допускается. При наличии на стенках флакона нерастворенных частиц лиофилизата флакон можно слегка наклонить. Не взбалтывать во избежание пенообразования. Допустимо образование небольших пузырьков воздуха на поверхности жидкости. Растворение обычно происходит за несколько минут, в некоторых случаях требуется до 15 минут.
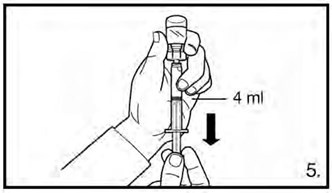
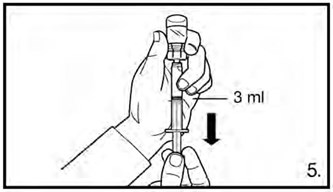
- Перевернуть флакон и набрать 3 мл раствора для дозировки 120 мг или 4 мл раствора для дозировки 80 мг до отметки на шприце. Перед инъекцией необходимо удостовериться, что отобран точный объем раствора и что в препарате отсутствуют пузырьки воздуха.
- Отсоединить шприц от переходника и надеть на шприц иглу для инъекции.
- Выполнить подкожную инъекцию: обхватить и приподнять кожу на животе и ввести иглу под углом не менее 45° глубоко в кожную складку, медленно ввести раствор.
- Не рекомендуется вводить препарат в области, подвергающиеся давлению (например, области ношения ремня или пояса, область ребер).
- Только для препарата Фирмагон, лиофилизат для приготовления раствора для подкожного введения, 120 мг
- ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
- ДАТА ПЕРЕСМОТРА ТЕКСТА
ДЕКАПЕПТИЛ ДЕПО (трипторелина ацетат)
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИНСТРУКЦИЯ
ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Декапептил депо
Регистрационный номер: П N008612
Торговое наименование: Декапептил депо
Международное непатентованное наименование: трипторелин
Лекарственная форма: порошок для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия
Состав
Порошок
1 шприц содержит:
действующее вещество: трипторелина ацетат 4,12 мг (эквивалентно трипторелину (основание) 3,75 мг);
вспомогательные вещества: молочной и гликолевой кислот сополимер 156 мг, пропиленгликоля дикаприлокапрат 12 мг.
Растворитель
1 шприц содержит:
полисорбат 80 10,4 мг, декстран 70 104 мг, натрия хлорид 8,11 мг, натрия дигидрофосфата дигидрат 1,62 мг, 1 H раствор натрия гидроксида 0,0066 мл, вода для инъекций 916,21 мг.
Описание
Порошок: порошок или пористая масса от белого до светло-желтого цвета без запаха.
Растворитель: бесцветная или светло-желтого цвета жидкость с характерным запахом полисорбата 80.
Восстановленная суспензия: гомогенная суспензия от молочно-белого до светло-желтого цвета с характерным запахом полисорбата 80.
Фармакотерапевтическая группа: противоопухолевое средство – гонадотропин-рилизинг гормона аналог.
Код АТХ: L02AE04.
Фармакологические свойства
Фармакодинамика
Действующее вещество препарата Декапептил депо - трипторелин – синтетический декапептидный аналог гонадотропин-рилизинг гормона (ГнРГ), синтезируемого в гипоталамусе. Трипторелин обладает более длительным действием, чем ГнРГ. Его действие осуществляется в два этапа. Сразу после введения трипторелин вызывает повышение концентрации фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) в крови, что приводит к кратковременному повышению концентрации половых гормонов – тестостерона у мужчин и эстрогенов у женщин. Продолжительная стимуляция гипофиза (в случае постоянной концентрации трипторелина в крови) приводит к блокаде гонадотропной функции, результатом чего является снижение концентрации половых гормонов в крови до посткастрационного или менопаузального уровня и подавление функции яичек и яичников.
Концентрация дегидроэпиандростерона в плазме крови остается неизменной. Это приводит к снижению роста тестостерончувствительных опухолей предстательной железы, к уменьшению очагов эндометриоза и эстрогензависимых миом матки. При миоме матки максимальный эффект от лечения наблюдается у женщин с анемией (гемоглобин ≤ 8 г/дл).
У детей с преждевременным половым созреванием применение трипторелина подавляет секрецию гонадотропинов и, соответственно, половых гормонов до уровня препубертатного периода. Это замедляет процесс полового созревания и позволяет дать прогноз предполагаемому росту пациента во взрослом возрасте.
Ингибирование трипторелином гонадотропной функции гипофиза предупреждает повышение концентрации ЛГ, вследствие чего не происходит преждевременная овуляция и/или лютеинизация фолликула. В результате применения агонистов ГнРГ снижается частота прерывания цикла экстракорпорального оплодотворения (ЭКО), что позволяет повысить частоту наступления беременности при проведении вспомогательных репродуктивных технологий (ВРТ).
Фармакокинетика
После внутримышечного (в/м) введения препарата Декапептил депо концентрация трипторелина в плазме крови определяется его медленным контролируемым высвобождением из полимера гликолевой и молочной кислот.
В первые часы после в/м или подкожного (п/к) введения препарата Декапептил депо регистрируется максимальная концентрация трипторелина в плазме крови. Затем концентрация трипторелина заметно снижается в течение 24 ч. На 4-й день после инъекции концентрация трипторелина в крови достигает второго максимума, вслед за которым концентрация снижается в биэкспоненциальном порядке до неопределяемых значений в течение 44 дней. После п/к введения препарата увеличение концентрации трипторелина в плазме крови происходит более плавно с достижением более низких значений, чем после в/м введения. Также, после п/к введения снижение концентрации трипторелина происходит медленнее, чем после в/м введения; значения концентрации опускаются ниже предела обнаружения через 65 дней.
В шестимесячных курсах лечения с интервалом в 28 дней инъекции препарата Декапептил депо не приводят к повышению его концентрации в крови. При в/м и п/к введении концентрация трипторелина в крови накануне очередной инъекции снижалась примерно до 100 пг/мл (среднее значение). Предполагается, что метаболизм в месте инъекции несистемно доступного количества трипторелина осуществляется макрофагами.
В гипофизе системно доступный трипторелин инактивируется N-концевым расщеплением с помощью фермента пироглутамилпептидазы и нейтральной эндопептидазы. В печени и почках трипторелин распадается до биологически неактивных пептидов и аминокислот.
Через 40 минут после введения трипторелина в дозе 100 мкг (при продолжительности введения более 1 часа) 3-14 % от введенной дозы в неизмененном виде выводится почками.
У мужчин
У мужчин постоянная биологическая доступность трипторелина из депо после в/м введения составляет 38,3 % в первые 13 дней. Далее высвобождение препарата становится линейным со средним ежедневным значением – 0,92 % от введенной дозы. Биодоступность препарата после п/к введения составляет 69 % по сравнению с в/м введением.
У женщин
У женщин после 27 дней исследования в среднем определяется 35,7 % от первоначально введенной дозы, при этом 25,5 % дозы высвобождается в первые 13 дней с последующим линейным высвобождением в среднем, по 0,73 % от введенной дозы ежедневно.
Фармакокинетика в особых клинических случаях
Пациенты с нарушением функции почек
Для пациентов с нарушениями функции почек подбор и коррекция дозы препарата Декапептил депо считаются необязательными в связи с второстепенной значимостью выведения трипторелина почками и его широким терапевтическим диапазоном
Показания к применению
У женщин
У мужчин
У детей
Противопоказания
Общие противопоказания
У женщин
У мужчин
У пациентов с гормононезависимым раком предстательной железы.
Состояние после предшествующей хирургической двухсторонней орхиэктомии.
У детей
С осторожностью
Применение во время беременности и в период грудного вскармливания
Беременность
Препарат противопоказан к применению при беременности.
Перед началом терапии трипторелином у женщин с сохраненным репродуктивным потенциалом следует исключить наличие беременности. При применении трипторелина рекомендуется использовать барьерные методы контрацепции до наступления менструации. При наступлении беременности во время лечения терапию трипторелином необходимо прекратить.
Связь применения трипторелина и развития аномалий ооцитов или плода при беременности не установлена.
Данные о влиянии трипторелина на повышение риска возникновения внутриутробных пороков развития при беременности ограничены. В ходе доклинических исследований была выявлена репродуктивная токсичность. На основании данных о фармакологическом действии трипторелина нельзя исключить возможность неблагоприятного воздействия трипторелина на течение беременности и развитие плода.
Период грудного вскармливания
Данных о проникновении трипторелина в грудное молоко человека нет. В связи с потенциальным риском развития нежелательных реакций у ребенка, применение трипторелина в период грудного вскармливания противопоказано.
Способ применения и дозы
Терапия препаратом Декапептил депо должна проводиться врачом, имеющим опыт лечения трипторелином, а также при наличии квалифицированного медицинского персонала и соответствующего оборудования для контроля эффективности терапии.
Применение трипторелина у детей должно осуществляться под наблюдением детского эндокринолога, педиатра или эндокринолога с опытом лечения преждевременного полового созревания центрального генеза.
Инъекцию следует проводить в строгом соответствии с инструкцией по приготовлению и введению препарата.
Во избежание образования осадка восстановленную суспензию следует вводить сразу же после разведения.
Режим дозирования и способ применения
Содержимое 1 шприца с препаратом Декапептил Депо, что соответствует 3,75 мг трипторелина, вводится п/к (в область живота, бедра или ягодицы) или глубоко в/м 1 раз каждые 28 дней. Место введения препарата при каждой инъекции следует менять.
Перед началом терапии женщинам следует прекратить прием всех лекарственных препаратов, содержащих эстрогены (например, пероральные контрацептивы). При применении трипторелина для лечения эндометриоза и фибромиомы матки рекомендуется использовать барьерные методы контрацепции.
У мужчин
Терапия гормонозависимого местно распространенного или метастатического рака предстательной железы
По 3,75 мг трипторелина 1 раз в 4 недели. Для длительного снижения концентрации тестостерона рекомендуется проводить 4-недельный курс терапии.
Терапия рака предстательной железы препаратом Декапептил депо обычно длительная.
У женщин
Эндометриоз и миома матки
По 3,75 мг трипторелина 1 раз в 4 недели. Лечение следует начинать в первые 5 дней менструального цикла.
Длительность лечения зависит от начальной степени тяжести эндометриоза и клинической картины (функциональных и анатомических проявлений), а также от начального размера миомы матки, определяемого с помощью УЗИ в ходе лечения. Как правило, максимальный результат достигается после 3-4 инъекций.
В связи с возможным влиянием на минеральную плотность костной ткани (МПКТ) длительность лечения не должна превышать 6 месяцев.
Профилактика преждевременного повышения концентрации ЛГ при проведении контролируемой стимуляции яичников с использованием ВРТ
По 3,75 мг трипторелина 1 раз на 2-й или 3-й день (фолликулярная фаза), или 22-й день (лютеиновая фаза) менструального цикла.
У детей
Преждевременное половое созревание центрального генеза (у девочек до 9 лет и мальчиков до 10 лет)
В начале лечения доза трипторелина подбирается с учетом массы тела, препарат вводится однократно в 0-й, 14-й и 28-й день. Затем введение осуществляется 1 раз в 4 недели. При недостаточной эффективности лечения допускается введение препарата 1 раз в 3 недели. Доза подбирается индивидуально с учетом массы тела в соответствии с таблицей:
|
Масса тела |
Доза препарата Декапептил депо |
|
< 20 кг |
1,875 мг (1/2 дозы) |
|
20-30 кг |
2,5 мг (2/3 дозы) |
|
> 30 кг |
3,75 мг (1 доза) |
Лечение следует прекратить, если у девочек старше 12 лет и у мальчиков старше 13 лет происходит ускорение роста костей.
Применение препарата в особых клинических группах пациентов
Пациенты пожилого возраста
При применении препарата у пациентов пожилого возраста коррекции дозы препарата не требуется.
Пациенты с нарушениями функции почек
Согласно имеющимся данным, при применении препарата у пациентов с нарушениями функции почек коррекция дозы или увеличение интервала между введениями не требуется.
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью коррекции дозы трипторелина не требуется.
Инструкция по приготовлению и введению препарата
Важная информация:
Описание содержимого упаковки препарата Декапептил депо:
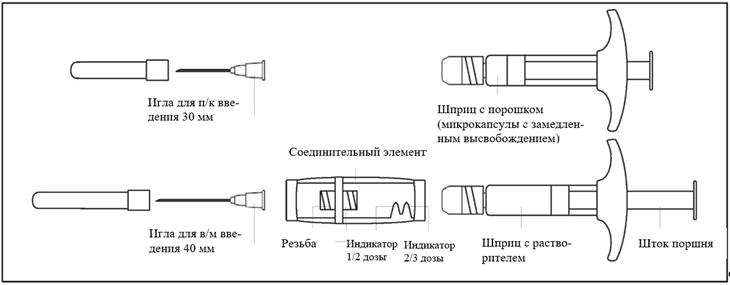
Для правильного разведения суспензии необходимо строго выполнять приведенные далее инструкции:
 |
A |
|
|
|
||
 |
B |
|
|
|
||
 |
C |
|
|
|
||
 |
D |
|
|
|
||
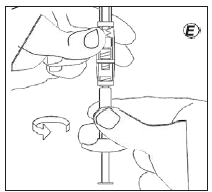 |
E |
|
Для разведения суспензии:
|
1/2 или 2/3 дозы для детей Чтобы отмерить 1/2 или 2/3 дозы следует использовать указатели доз на соединительном элементе: |
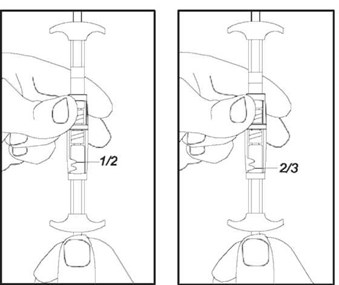 |
|
|
1/2 дозы |
2/3 дозы |
|

Препарат Декапептил депо предназначен только для однократного введения, весь оставшийся лекарственный препарат следует утилизировать в установленном порядке.
Побочное действие
Ниже представлены сведения о нежелательных реакциях, возникших у пациентов в ходе клинических исследований и при пострегистрационном применении. Вследствие снижения концентрации тестостерона и эстрогена многие пациенты сообщали о нежелательных реакциях, наиболее часто о развитии «приливов» крови к лицу (у 30 % мужчин и 75-100 % женщин). Также сообщалось об импотенции и снижении либидо у 30-40 % мужчин и о маточном кровотечении/кровянистых выделениях, повышенном потоотделении, сухости слизистой влагалища и/или диспареунии, снижении либидо, головной боли, эмоциональной лабильности у более чем 10 % женщин.
В связи с тем, что в течение первой недели лечения концентрация тестостерона обычно повышается, может наблюдаться ухудшение симптомов и жалобы пациентов (например, непроходимость мочевыводящих путей, метастатические боли в костях, компрессия спинного мозга, мышечная слабость, лимфедема нижних конечностей). В некоторых случаях непроходимость мочевыводящих путей снижает функцию почек. Может наблюдаться компрессия нервов, проявляющаяся в форме астении и парестезии нижних конечностей.
Нежелательные реакции, возможные при применении трипторелина, распределены по системно-органным классам с указанием частоты их развития, согласно рекомендациям ВОЗ: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), частота не установлена (не может быть оценена на основании имеющихся данных).
У мужчин
Наиболее частые нежелательные реакции при применении трипторелина связаны с его фармакологическим действием: начальное увеличение концентрации тестостерона в плазме крови, а затем почти полное подавление синтеза тестостерона. Это такие нежелательные реакции как: «приливы» крови к лицу (41 %), эректильная дисфункция (44 %) и снижение либидо (40 %).
Сообщалось о нежелательных реакциях, возможно связанных с лечением трипторелином.
Большинство из них также связаны с химической или хирургической кастрацией.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Частота не установлена |
|
Инфекционные и паразитарные заболевания |
|
|
|
Назофарингит |
|
Нарушения со стороны иммунной системы |
|
Гиперчувстви-тельность |
Анафилактиче- |
|
|
Нарушения со стороны обмена веществ и питания |
|
|
Снижение |
Повышение аппетита, подагра, сахарный диабет |
|
Нарушения психики |
Снижение либидо |
Эмоциональная лабильность, подавленное настроение, депрессия, нарушения сна |
|
Бессонница, спутанность сознания, снижение активности, эйфория, тревожность, потеря полового влечения |
|
Нарушения со стороны нервной системы |
|
Головная боль |
|
Головокружение, парестезия, нарушение памяти, дисгевзия, сонливость, дисстазия |
|
Нарушения со стороны органа зрения |
|
|
|
Неприятные ощущения в глазах, нарушение зрения, снижение четкости зрения |
|
Нарушения со стороны органа слуха и лабиринтные нарушения |
|
|
|
Звон в ушах, вертиго |
|
Нарушения со стороны сосудов |
«Приливы» крови к лицу |
|
Тромбоэмболия, артериальная гипертензия |
Артериальная гипотензия |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Обострение бронхиальной астмы |
Одышка, ортопноэ, носовое кровотечение |
|
Нарушения со стороны желудочно-кишечного тракта |
|
Тошнота |
Боль в эпигастральной области, сухость во рту |
Боль в животе, запор, диарея, рвота, вздутие живота, метеоризм, гастралгия |
|
Нарушения со стороны кожи и подкожных тканей |
|
Повышенное потоотделение |
Гипотрихоз, облысение |
Акне, зуд, сыпь, везикулярная сыпь, ангионевротический отек, крапивница, пурпура |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
Боль в костях |
Миалгия, артралгия |
|
Боль в спине, боль в конечностях, мышечный спазм, мышечная слабость, скованность в суставах, припухлость суставов, скованность мышц и суставов, остеоартрит |
|
Нарушения со стороны почек и мочевыводящих путей |
Дизурия |
|
|
|
|
Нарушения со стороны половых органов и грудной железы |
Эректильная дисфункция |
Гинекомастия |
Атрофия яичек |
Боль в грудных железах, боль в яичках, расстройство семяизвержения |
|
Общие расстройства и нарушения в месте введения |
|
Утомляемость, реакции в месте введения, боль в месте введения, раздражение |
|
Астения, эритема в месте введения, воспаление в месте введения, отек, боль, озноб, боль в груди, гриппоподобное состояние, лихорадка, недомогание |
|
Лабораторные и инструментальные данные |
|
|
Повышение активности ЛДГ, ГГТ, АСТ, АЛТ в крови, увеличение массы тела, уменьшение массы тела |
Повышение концентрации креатинина в крови, повышение концентрации мочевины в крови, повышение активности щелочной фосфатазы, повышение температуры тела, удлинение интервала QT |
Трипторелин вызывает временное увеличение концентрации тестостерона в крови в течение первой недели после первого введения. Вместе с первоначальным повышением концентрации тестостерона в крови у некоторых пациентов (≤ 5 %) может наблюдаться временное обострение признаков и симптомов рака предстательной железы (транзиторное ухудшение клинических проявлений опухоли), которое обычно проявляется в виде усиления симптомов со стороны мочевыводящих путей (< 2 %) и метастатической боли (5 %), подлежащих симптоматическому лечению. Эти симптомы носят временный характер и обычно проходят в течение 1-2 недель.
Наблюдались отдельные случаи обострения симптомов болезни – непроходимость мочеиспускательного канала или компрессии спинного мозга, вызванной метастазом. Таким образом, пациенты, с метастатическими вертебральными поражениями и/или непроходимостью верхних или нижних мочевыводящих путей в течение первых недель лечения должны находиться под наблюдением врача.
Применение агонистов ГнРГ для лечения рака предстательной железы может сопровождаться ускоренной резорбцией костной ткани, может приводить к остеопорозу и повышает риск переломов костей.
У женщин
В связи со снижением концентрации эстрогена чаще (≥ 10 % женщин) встречались такие нежелательные реакции как головная боль, снижение либидо, нарушения сна, эмоциональная лабильность, диспареуния, дисменорея, генитальное кровотечение, синдром гиперстимуляции яичников (СГЯ), увеличение яичников, тазовая боль, боль в животе, сухость слизистой влагалища, повышенное потоотделение, «приливы» крови к лицу и астения.
Сообщалось о нежелательных реакциях, возможно связанных с лечением трипторелином. Большинство из них также связаны с химической или хирургической кастрацией.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Частота не установлена |
|
Нарушения со стороны иммунной системы |
|
Гиперчувствительность |
Анафилактические реакции |
|
|
Нарушения психики |
Снижение либидо, эмоциональная лабильность, нарушения сна |
Подавленное настроение, депрессия |
|
Спутанность сознания, тревожность |
|
Нарушения со стороны нервной системы |
Головная боль |
|
Парестезия |
Головокружение |
|
Нарушения со стороны органа зрения |
|
|
Нарушение зрения |
Снижение четкости зрения |
|
Нарушения со стороны органа слуха и лабиринтные нарушения |
|
|
|
Вертиго |
|
Нарушения со стороны сосудов |
«Приливы» крови к лицу |
|
|
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
|
Одышка |
|
Нарушения со стороны желудочно-кишечного тракта |
Боль в животе |
Тошнота |
|
Дискомфорт в животе, диарея, рвота |
|
Нарушения со стороны кожи и подкожных тканей |
Повышенное потоотделение |
|
|
Зуд, сыпь, ангионевротический отек, крапивница |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
Боль в костях |
Миалгия, артралгия |
Боль в спине |
Остеопороз(*), мышечный спазм, мышечная слабость |
|
Нарушения со стороны половых органов и молочной железы |
Вагинальное кровотечение, сухость слизистой влагалища, диспареуния, дисменорея, СГЯ, увеличение яичников, тазовая боль |
|
|
Боль в молочных железах, меноррагия, метроррагия, аменорея |
|
Общие расстройства и нарушения в месте введения |
Астения |
Утомляемость, реакции в месте введения, боль в месте введения, раздражение |
|
Эритема в месте введения, воспаление в месте введения, лихорадка, недомогание |
|
Лабораторные и инструментальные данные |
|
|
Повышение активности ЛДГ, ГГТ, АСТ, АЛТ, повышение концентрации холестерина в крови |
Повышение артериального давления, увеличение массы тела, уменьшение массы тела |
(*) Может приводить к незначительной потере губчатого вещества кости. Симптомы обычно исчезают в течение 6-9 месяцев после прекращения лечения.
В начале лечения очень распространенным (≥ 10 %) является обострение симптомов эндометриоза, включая боль в области таза и дисменорею, вызванные начальным временным повышением концентрации эстрадиола в плазме крови. Эти симптомы носят временный характер и обычно проходят в течение 1-2 недель.
Генитальное кровотечение, включая меноррагию и метроррагию, может возникать через месяц после первого введения препарата. Могут наблюдаться увеличение яичников, боль в области таза и/или живота.
Введение гонадотропинов, применяемых в циклах ВРТ, снижает выраженность нежелательных реакций, вызванных применением трипторелина, в результате чего симптомы сохраняются не более двух дней.
Лечение бесплодия аналогами ГнРГ может привести к развитию СГЯ. Рост фолликулов и начало лютеиновой фазы менструального цикла следует тщательно контролировать с помощью УЗИ.
Сообщалось о случаях многоплодной беременности.
При лечении миомы матки следует регулярно определять размеры матки и миомы с помощью, например УЗИ.
Непропорционально быстрое уменьшение размеров матки по сравнению с сокращением тканей миомы в отдельных случаях приводило к кровотечению и сепсису.
У детей
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Частота не установлена |
|
Нарушения со стороны иммунной системы |
|
|
Анафилактические реакции |
Реакции гиперчувствительности |
|
Нарушения психики |
|
Эмоциональная лабильность, депрессия |
|
Аффективная лабильность, нервозность |
|
Нарушения со стороны нервной системы |
|
|
|
Головная боль, идиопатическая внутричерепная гипертензия (ложная опухоль головного мозга)1 |
|
Нарушения со стороны органа зрения |
|
|
|
Снижение четкости зрения, нарушение зрения |
|
Нарушения со стороны сосудов |
|
|
|
«Приливы» крови к лицу |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
|
Носовое кровотечение |
|
Нарушения со стороны желудочно-кишечного тракта |
|
|
Тошнота, рвота |
Дискомфорт в животе, боль в животе |
|
Нарушения со стороны кожи и подкожных тканей |
|
|
|
Сыпь, ангионевротический отек, крапивница, облысение, эритема |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|
|
|
Эпифизеолиз2, миалгия |
|
Нарушения со стороны половых органов и молочной железы |
|
|
Вагинальное кровотечение, выделения из влагалища |
Генитальное кровотечение |
|
Общие расстройства и нарушения в месте введения |
|
|
|
Эритема в месте введения, воспаление в месте введения, недомогание, боль в месте введения |
|
Лабораторные и инструментальные данные |
|
|
|
Повышение артериального давления, увеличение массы тела |
1 См. раздел «Особые указания»
2 Сообщалось о нескольких случаях эпифизеолиза головки бедра при применении трипторелина.
Сообщалось о случаях увеличения имеющейся аденомы гипофиза при лечении агонистами ГнРГ, однако связь этих случаев с применением трипторелина не установлена.
Передозировка
О случаях передозировки трипторелином не сообщалось.
Фармакологические свойства трипторелина и способ применения делают случайную или преднамеренную передозировку маловероятной.
В случае передозировки необходимо проводить симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Исследований взаимодействия трипторелина с другими лекарственными средствами не проводилось.
Нельзя исключить взаимодействие трипторелина с лекарственными препаратами, усиливающими высвобождение гистамина.
Необходимо тщательное медицинское наблюдение и контроль концентрации половых гормонов при применении трипторелина у пациентов, получающих лекарственные препараты, влияющие на секрецию гонадотропинов.
Поскольку проведение антиандрогенной терапии может вызвать удлинение интервала QT, следует с осторожностью применять трипторелин с лекарственными препаратами, удлиняющими интервал QT, или с лекарственными препаратами, индуцирующими развитие желудочковой тахикардии типа «пируэт», такими как антиаритмические средства класса IA (хинидин, дизопирамид), или класса III (амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики и прочие препараты с указанным действием.
Теоретически возможно влияние блокаторов кальциевых каналов на механизм действия ГнРГ и аналогов ГнРГ. Однако первоначальные результаты исследований на длительное снижение концентрации тестостерона препаратом Декапептил депо при одновременном применении с блокаторами кальциевых каналов не показали результатов такого взаимодействия.
Особые указания
Общие
Применение агонистов ГнРГ может приводить к снижению МПКТ.
У мужчин применение бисфосфонатов в комбинации с агонистами ГнРГ уменьшает потерю МПКТ.
С особой осторожностью следует применять препарат для лечения пациентов с дополнительными факторами риска развития остеопороза (например, хронический алкоголизм; курение; длительная терапия препаратами, снижающими МПКТ, такими как противосудорожные препараты или глюкокортикостероиды; остеопороз в семейном анамнезе; нарушения питания).
В редких случаях терапия агонистами ГнРГ может выявить наличие ранее не диагностированной гонадотропиномы (гонадотропин-секретирующая аденома гипофиза). У таких пациентов может развиваться кровоизлияние в гипофиз, характеризующееся внезапной головной болью, рвотой, нарушением зрения и офтальмоплегией.
У пациентов, получающих терапию агонистами ГнРГ, такими как трипторелин, наблюдается повышенный риск развития депрессивных состояний (которые могут быть тяжелыми). Пациенты должны быть проинформированы, и при необходимости должно быть назначено соответствующее лечение.
Сообщалось о случаях эмоциональной лабильности. Пациенты с диагностированными депрессивными состояниями должны находиться под медицинским наблюдением во время терапии трипторелином.
У мужчин
Трипторелин, как и остальные агонисты ГнРГ, вызывает временное повышение концентрации тестостерона в крови. В результате отмечались отдельные случаи временного ухудшения признаков и симптомов рака предстательной железы на первых неделях лечения. На начальном этапе лечения рекомендуется дополнительный прием соответствующего антиандрогенного препарата для предотвращения первичного повышения концентрации тестостерона и ухудшения клинической картины.
У незначительного процента пациентов может возникать временное ухудшение признаков и симптомов рака предстательной железы (транзиторное ухудшение клинических проявлений опухоли) и временное усиление онкологически обусловленной боли (метастатическая боль), которые лечатся симптоматически.
Как и при применении других агонистов ГнРГ, наблюдались отдельные случаи компрессии спинного мозга или непроходимости мочевыводящих путей. При развитии компрессии спинного мозга или почечной недостаточности следует применять стандартное лечение этих осложнений, а в крайних случаях рекомендуется немедленная орхиэктомия. На первых неделях лечения рекомендуется тщательное наблюдение, особенно у пациентов с метастатическим вертебральным поражением, в связи с риском возникновения компрессии спинного мозга, а также у пациентов с непроходимостью мочевыводящих путей.
После орхиэктомии трипторелин не вызывает дальнейшего снижения концентрации тестостерона в крови.
Длительная андрогенная депривация в связи с двусторонней орхиэктомией или применением аналогов ГнРГ вызывает ускоренную резорбцию костной ткани, что может привести к остеопорозу и повышению риска переломов костей.
Антиандрогенная терапия может способствовать удлинению интервала QT.
Перед применением трипторелина у пациентов с наличием в анамнезе эпизодов удлинения интервала QT или соответствующими факторами риска, а также у пациентов, получающих лекарственные препараты, способные удлинять интервал QT, необходимо проводить оценку соотношения ожидаемая польза – возможный риск и учитывать вероятность развития желудочковой тахикардии типа «пируэт».
Кроме того, согласно полученным данным, во время антиандрогенной терапии у пациентов наблюдались изменения обмена веществ (например, нарушение толерантности к глюкозе, жировая дегенерация печени) или повышение риска сердечно-сосудистых заболеваний. Однако данные клинических исследований не подтверждают связь между лечением аналогами ГнРГ и повышением уровня смертности от сердечно-сосудистых заболеваний. Пациенты с высоким риском нарушения обмена веществ или сердечно-сосудистых заболеваний перед началом лечения должны пройти тщательное обследование и находиться под надлежащим контролем при проведении антиандрогенной терапии.
Применение трипторелина в терапевтических дозах вызывает угнетение гипофизарно-гонадной системы. Нормальное функционирование обычно восстанавливается после окончания лечения. Таким образом, диагностические тесты гипофизарно-гонадной функции во время и после завершения лечения агонистами ГнРГ могут не отражать полную клиническую картину.
У женщин
Трипторелин следует применять только после проведения полной диагностики (например, лапароскопии).
Перед применением трипторелина следует убедиться, что пациентка не беременна.
На фоне применения трипторелина наступает аменорея, поэтому, если регулярные менструации продолжаются, пациентке следует сообщить об этом лечащему врачу.
Потеря минеральной плотности костной ткани
Применение агонистов ГнРГ в течение 6-месячного курса лечения может вызывать снижение МПКТ в среднем на 1 % в месяц. Снижение МПКТ на каждые 10 % увеличивает риск возникновения переломов примерно в 2-3 раза. По этой причине продолжительность лечения без применения дополнительной поддерживающей терапии не должна превышать 6 месяцев. Восстановление костной массы происходит в течение 6-9 месяцев после прекращения лечения.
Имеющиеся данные свидетельствуют о том, что у большинства женщин восстановление костной массы происходит после прекращения лечения.
Отсутствуют данные о пациентах с тяжелым остеопорозом или с высоким фактором риска развития остеопороза (например, хронический алкоголизм, курение, длительная терапия препаратами, снижающими МПКТ, такими как противосудорожные препараты или глюкокортикостероиды, остеопороз в семейном анамнезе, нарушения питания, например, нервная анорексия). Поскольку у таких пациентов уменьшение МПКТ может быть более опасным, решение о лечении трипторелином следует принимать в индивидуальном порядке после тщательного анализа и только в случае, если ожидаемая польза лечения превышает возможный риск. При этом следует назначать терапию для восстановления МПКТ.
Миома матки и эндометриоз
Если у пациентки возникает маточное кровотечение (за исключением первого месяца), нужно проверить концентрацию эстрогена в крови. Если этот показатель ниже 50 пг/мл, следует искать возможные органические нарушения. После окончания лечения функция яичников восстанавливается, например, менструальные кровотечения возобновляются через 7-12 недель после последней инъекции.
В течение первого месяца лечения следует использовать барьерные методы контрацепции, поскольку первичная секреция гонадотропинов может стимулировать овуляцию. Использование указанного вида контрацепции следует продолжить, начиная с 4 недели после последней инъекции и вплоть до восстановления менструации или до назначения нового метода контрацепции.
При лечении миомы матки необходимо регулярно определять размер матки и миомы, например, с помощью УЗИ. Непропорционально быстрое уменьшение размеров матки по сравнению с сокращением тканей миомы в отдельных случаях приводило к кровотечению и сепсису.
Сообщалось о случаях кровотечения у пациенток с субмукозной миомой после лечения аналогами ГнРГ. Обычно кровотечение начиналось через 6-10 недель после начала лечения.
Вспомогательные репродуктивные технологии
Применение ВРТ сопряжено с повышенным риском многоплодной беременности, внутриутробной гибели плода, эктопической беременности и врожденных пороков развития плода. Такие риски возможны при применении трипторелина в качестве вспомогательной терапии при контролируемой стимуляции яичников. Применение препарата во время контролируемой гиперстимуляции яичников может повысить риск развития СГЯ и кист яичников.
Стимуляция фолликулов, вызванная применением аналогов ГнРГ и гонадотропинов, может заметно усиливаться у небольшого количества пациенток, особенно при СПКЯ.
Как и у других аналогов ГнРГ, сообщалось о случаях развития СГЯ при применении трипторелина в сочетании с гонадотропинами.
Синдром гиперстимуляции яичников
СГЯ – синдром, отличный от неосложненного увеличения яичников, проявляется более выраженной степенью тяжести. Он включает в себя значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов. Последнее может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полостях.
При СГЯ тяжелой степени наблюдаются следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, включая тошноту, рвоту и диарею. При клиническом обследовании могут быть выявлены гиповолемия, гемоконцентрация, электролитные нарушения, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острый респираторный дистресс-синдром и тромбоэмболические осложнения.
Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится человеческий хорионический гонадотропин (чХГ) с целью стимуляции овуляции. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции не менее 4 дней. СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным медицинским осложнением, в связи с чем пациентки должны наблюдаться, по крайней мере, в течение 2-х недель после введения чХГ.
СГЯ может быть более тяжелым и затяжным в случае наступления беременности. Чаще всего СГЯ развивается после прекращения лечения гонадотропинами, достигает максимума тяжести в течение 7-10 дней после окончания лечения. Обычно СГЯ проходит спонтанно после начала менструации.
При развитии СГЯ тяжелой степени терапию гонадотропинами прекращают, пациентку госпитализируют и начинают специфическую терапию, например, покой, внутривенное введение электролитов или коллоидных растворов и гепарина.
Развитие СГЯ более характерно для пациенток с СПКЯ.
Риск развития СГЯ может повышаться при применении агонистов ГнРГ в сочетании с гонадотропинами в сравнении с применением только гонадотропинов.
Кисты яичников
На начальном этапе лечения агонистами ГнРГ могут образовываться кисты яичников. Обычно они бессимптомные и нефункциональные.
У детей
Биологический возраст детей при начале лечения преждевременного полового созревания центрального генеза должен составлять до 9 лет у девочек и до 10 лет у мальчиков.
У девочек в течение первого месяца лечения начальная стимуляция яичников с последующим выбросом эстрогена, в ответ на введение препарата, может привести к вагинальному кровотечению легкой или средней степени.
Через некоторое время после завершения терапии начинается половое созревание. Данные о потенциальной фертильности ограничены. У большинства девочек менархе наступает в среднем через 1 год после завершения лечения, и, как правило, менструальный цикл регулярный.
Во время лечения преждевременного полового созревания центрального генеза агонистами ГнРГ может снижаться МПКТ. Однако, после прекращения лечения происходит дальнейшее накопление костной массы, а на максимальную костную массу в позднем пубертатном периоде лечение не влияет.
После прекращения лечения агонистами ГнРГ может развиваться эпифизеолиз головки бедра. Существует мнение, что низкая концентрация эстрогенов при лечении агонистами ГнРГ оказывает влияние на эпифизарную пластинку и вызывает ее истончение. Ускорение роста после завершения лечения приводит к уменьшению силы среза, необходимой для смещения эпифиза.
Перед лечением детей с прогрессирующими опухолями мозга в каждом отдельном случае следует осуществлять тщательную оценку потенциальных рисков и ожидаемой пользы.
Необходимо предварительно исключить преждевременное половое созревание вследствие опухоли половых органов или надпочечников, гиперплазии, и гонадотропин-независимое преждевременное половое созревание (поражение яичек вследствие интоксикации, наследственная гиперплазия клеток Лейдига).
Сообщалось об аллергических и анафилактических реакциях у взрослых и детей. К ним относятся реакции в месте введения, а также системные проявления. Определить патогенез не представлялось возможным. Большую частоту имели случаи аллергических реакций у детей.
Идиопатическая внутричерепная гипертензия
Сообщалось о развитии идиопатической внутричерепной гипертензии (ложная опухоль головного мозга) у детей, принимавших трипторелин. Пациентов следует предупредить о возможном появлении признаков и симптомов идиопатической внутричерепной гипертензии, включая сильную или периодическую головную боль, нарушения зрения и шум в ушах. При возникновении идиопатической внутричерепной гипертензии следует рассмотреть вопрос о прекращении терапии трипторелином.
Препарат содержит натрий (менее 1 ммоль (23 мг) на дозу).
Влияние на способность управлять транспортными средствами и механизмами
Исследования влияния препарата Декапептил депо на способность управлять транспортными средствами и работать с механизмами не проводились. Однако, с учетом возможного развития нежелательных реакций при применении препарата (головокружение, сонливость и нарушение зрения) необходимо соблюдать осторожность при управлении транспортными средствами и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Порошок для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия, 3,75 мг.
По 3,75 мг действующего вещества в одноразовом шприце объемом 2,25 мл.
По 1 мл растворителя в одноразовом шприце.
По 1 шприцу с порошком и 1 шприцу с растворителем вместе с соединительным элементом и 2 иглами для инъекций в контурной ячейковой упаковке в картонной пачке с инструкцией по медицинскому применению.
Допускается наличие контроля первого вскрытия.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить при температуре от 2 до 8 °С в оригинальной упаковке.
Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Держатель (владелец) регистрационного удостоверения
Ферринг ГмбХ,
Витланд 11, 24109 Киль, Германия.
Производитель
Ферринг ГмбХ,
Витланд 11, 24109 Киль, Германия.
Организация, принимающая претензии от потребителей
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб., д.52, стр.4.
Тел.: + 7 (495) 287-0343.
Факс: +7 (495) 287-0342.
ФИРМАГОН (дегареликс)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
Действующее вещество: дегареликс.
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения Каждый флакон содержит 80 мг дегареликса (в виде ацетата).
1 мл восстановленного раствора содержит 20 мг дегареликса.
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
Каждый флакон содержит 120 мг дегареликса (в виде ацетата).
1 мл восстановленного раствора содержит 40 мг дегареликса.
Полный перечень вспомогательных веществ приведен в разделе 6.1.
Лиофилизат для приготовления раствора для подкожного введения.
Лиофилизат: белая или почти белая лиофилизированная масса.
Растворитель: прозрачная бесцветная жидкость.
4.1. Показания к применению
Препарат Фирмагон показан для терапии распространенного гормонозависимого рака предстательной железы у взрослых мужчин.
4.2. Режим дозирования и способ применения
Режим дозирования
|
Начальная доза |
Поддерживающая доза – ежемесячно |
|
240 мг, вводится однократно подкожно в виде 2-х инъекций по 120 мг |
80 мг, вводится подкожно в виде 1 инъекции |
Первое введение поддерживающей дозы проводится через 1 месяц после введения начальной дозы.
Терапевтический эффект препарата Фирмагон следует отслеживать по клиническим параметрам и концентрации простатспецифического антигена (ПСА) в сыворотке крови. Подавление выработки тестостерона (Т) происходит сразу же после введения начальной дозы, при этом концентрация Т в сыворотке крови падает до кастрационного уровня (Т ≤ 0,5 нг/мл) у 96 % пациентов через 3 дня, у 100 % пациентов – через 1 месяц. Длительная, до 1 года, поддерживающая терапия обеспечивает подавление выработки Т ≤ 0,5 нг/мл у 97 % пациентов.
Если у пациента терапевтический эффект выражен недостаточно, следует удостовериться, что концентрация Т в сыворотке крови остается сниженной в достаточной степени.
Препарат Фирмагон не вызывает колебаний концентрации Т, поэтому нет необходимости принимать антиандрогенные препараты в начале лечения.
Особые группы пациентов
Пожилые пациенты, пациенты с нарушением функции почек или печени
У пожилых пациентов, при нарушениях функции почек или печени легкой и средней степени отсутствует необходимость в коррекции дозы препарата (см. раздел 5.2). Данные по применению дегареликса у пациентов с тяжелыми нарушениями функции почек или печени отсутствуют, препарат следует применять с осторожностью (см. раздел 4.4).
Дети
Препарат Фирмагон не предназначен для применения у детей и подростков до 18 лет.
Способ применения
Подкожно. Не вводить внутривенно! Эффективность и безопасность внутримышечного введения препарата Фирмагон не изучались.
Инъекции проводятся подкожно в область живота. Место инъекций необходимо периодически менять. Необходимо избегать мест, которые подвергаются давлению (например, около пояса или ремня и около ребер).
Инструкции по приготовлению раствора лекарственного препарата перед применением и выполнению инъекции см. в разделе 6.6.
4.3. Противопоказания
Гиперчувствительность к дегареликсу или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
4.4. Особые указания и меры предосторожности при применении
Влияние на QT/QTc интервал
Длительная супрессия андрогенных гормонов может вызвать удлинение интервала QT. В ходе подтверждающего клинического исследования проводилось сравнение ежемесячно снимаемых электрокардиограмм (ЭКГ) у пациентов, получавших препарат Фирмагон и лейпрорелин. У 20 % пациентов в обеих группах было выявлено удлинение интервала QT/QTc выше 450 мс; у 1 % пациентов, получавших дегареликс, и у 2 % пациентов, получавших лейпрорелин, было установлено удлинение интервала QT/QTc до 500 мс (см. раздел 5.1).
Не проводилось исследование применения препарата Фирмагон у пациентов с удлинением интервала QT свыше 450 мс в анамнезе, у пациентов с наличием или риском развития полиморфной желудочковой тахикардии типа «пируэт», а также у пациентов, одновременно принимающих лекарственные препараты, приводящие к удлинению интервала QT. Таким образом, необходимо оценить отношение ожидаемой пользы к возможному риску применения препарата Фирмагон в указанных случаях (см. разделы 4.5 и 4.8).
В ходе исследований не было выявлено непосредственного влияния дегареликса на интервал QT/QTc (см. раздел 4.8).
Нарушение функции печени
Пациенты с диагностированным или предполагаемым нарушением функции печени не включались в клинические исследования дегареликса. При применении препарата отмечалось незначительное преходящее повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). Концентрация билирубина не повышалась, не наблюдалось проявлений клинических симптомов нарушения функции печени. В ходе применения препарата рекомендуется контролировать показатели функции печени у пациентов с диагностированным или предполагаемым нарушением функции печени. Фармакокинетика дегареликса после однократного внутривенного введения изучалась у пациентов с нарушениями функции печени легкой или средней степени тяжести (см. раздел 5.2).
Нарушение функции почек
Исследования применения дегареликса у пациентов с почечной недостаточностью тяжелой степени не проводились. Таким образом, у данной категории пациентов препарат следует применять с осторожностью.
Реакции гиперчувствительности
Исследования применения дегареликса у пациентов с наличием в анамнезе тяжелой бронхиальной астмы, анафилактическими реакциями, тяжелой формой крапивницы или ангионевротических отеков не проводились.
Изменение минеральной плотности костной ткани
Изменение минеральной плотности костной ткани (МПКТ) при применении дегареликса не изучалось, однако в медицинской литературе сообщалось, что у пациентов, перенесших орхиэктомию или принимавших агонисты гонадотропин-рилизинг гормона (ГнРГ), наблюдается снижение МПКТ. Поэтому вследствие длительного подавления выделения Т, вызванного применением препарата Фирмагон, возможно снижение МПКТ.
Толерантность к глюкозе
Влияние дегареликса на концентрацию инсулина и глюкозы в крови не изучалось. Однако у пациентов, перенесших орхиэктомию или принимавших агонисты ГнРГ, наблюдается снижение толерантности к глюкозе и возможно развитие или декомпенсация сахарного диабета. Поэтому при применении антиандрогенной терапии рекомендуется более частый контроль концентрации глюкозы в крови.
Заболевания сердечно-сосудистой системы
Имеются сообщения о возможности развития сердечно-сосудистых заболеваний, включая инсульт и инфаркт миокарда, у пациентов, получающих антиандрогенную терапию. Таким образом, при назначении препарата, следует учитывать риск развития заболеваний сердечно-сосудистой системы.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Специальное исследование лекарственных взаимодействий не проводилось.
Поскольку при антиандрогенной терапии возможно удлинение интервала QTc, следует оценить необходимость одновременного применения дегареликса с препаратами, которые вызывают удлинение интервала QTc или желудочковую тахикардию типа «пируэт», например, антиаритмическими препаратами IA класса (хинидин, дизопирамид); антиаритмическими препаратами III класса (например, амиодарон, соталол, дофетилид, ибутилид), а также метадоном и моксифлоксацином, антипсихотическими средствами (нейролептиками) и другими лекарственными препаратами (см. раздел 4.4).
Клинически значимое фармакокинетическое взаимодействие дегареликса и лекарственных средств, в метаболизме которых принимает участие система цитохрома Р450, маловероятно, поскольку исследования in vitro показали, что дегареликс не является субстратом системы цитохрома Р450 и не ингибирует или индуцирует изоферменты CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5.
4.6. Фертильность, беременность и лактация
Беременность и лактация
Препарат Фирмагон не предназначен для применения у женщин.
Фертильность
Препарат Фирмагон может оказывать угнетающее воздействие на фертильность у мужчин за счет подавления выработки Т.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Фирмагон не оказывает или оказывает незначительное влияние на способность управлять транспортным средством и работать с механизмами. Нежелательные реакции, такие как повышенная утомляемость и головокружение, развивающиеся при применении препарата, могут влиять на способность управления транспортными средствами и работы с механизмами.
4.8. Нежелательные реакции
Резюме профиля безопасности
Наиболее частые нежелательные реакции (НР), наблюдаемые при применении дегареликса в ходе подтверждающего клинического исследования Фазы III (N = 409), были обусловлены физиологическим эффектом подавления выработки Т, включая такие НР, как приливы крови к лицу и увеличение массы тела (у 25 % и 7 % пациентов, получавших препарат в течение 1 года, соответственно) или реакции в месте введения. Озноб, повышение температуры тела или гриппоподобный синдром наблюдались в течение нескольких часов после введения препарата (у 3 %, 2 % и 1 % пациентов, соответственно).
НР в месте введения, в основном, проявляются в форме боли и покраснения (у 28 % и 17 % пациентов, соответственно), реже наблюдались такие НР как отек (6 %), уплотнение (4 %) и образование узелков (3 %). Такие реакции, в основном, наблюдаются при введении начальной дозы, тем временем, в ходе поддерживающей терапии (80 мг) частота таких проявлений на 100 инъекций составила 3 случая боли в месте введения и < 1 – покраснения, отека, образования узелков и уплотнения. Большинство указанных НР носили временный характер, были легкой или средней степени тяжести и редко приводили к прекращению терапии (< 1 %). Тяжелые реакции в месте введения, включая инфекцию, абсцесс или некроз в месте инъекции, требующие хирургического вмешательства/дренирования, наблюдались очень редко.
Табличное резюме нежелательных реакций
Частота НР: очень часто (≥ 1/10), часто (≥ 1/100, но < 1/10), нечасто (≥ 1/1000, но < 1/100), редко (≥ 1/10000, но < 1/1000), очень редко (< 1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно). В рамках одной градации частоты НР расположены в порядке убывания их серьезности.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Редко |
|
Нарушения со стороны крови и лимфатической системы |
|
Анемия* |
|
Фебрильная нейтропения |
|
Нарушения со стороны иммунной системы |
|
|
Гиперчувствительность |
Анафилактические реакции |
|
Нарушения метаболизма и питания |
|
Увеличение массы тела* |
Гипергликемия/сахарный диабет, увеличение концентрации холестерина, снижение массы тела, снижение аппетита, изменение концентрации кальция в плазме крови |
|
|
Психические нарушения |
|
Бессонница |
Депрессия, снижение либидо* |
|
|
Нарушения со стороны нервной системы |
|
Головокружение, головная боль |
Снижение интеллектуальной деятельности, гипестезия |
|
|
Нарушения со стороны органа зрения |
|
|
Нечеткость зрения |
|
|
Нарушения со стороны сердца |
|
|
Аритмия (включая фибрилляцию предсердий), ощущение сердцебиения, удлинение интервала QT* |
Инфаркт миокарда, острая сердечная недостаточность |
|
Нарушения со стороны сосудов |
Приливы крови к лицу* |
|
Артериальная гипертензия, вазовагальные реакции (включая артериальную гипотензию) |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Одышка |
|
|
Желудочно-кишечные нарушения |
|
Диарея, тошнота |
Запор, рвота, боль в животе, дискомфорт в брюшной полости, сухость во рту |
|
|
Нарушения со стороны печени и желчевыводящих путей |
|
Повышение активности «печеночных» трансаминаз |
Повышение концентрации билирубина, повышение активности щелочной фосфатазы |
|
|
Нарушения со стороны кожи и подкожных тканей |
|
Повышенное потоотделение (включая ночное)*, кожная сыпь |
Крапивница, образование узелков, алопеция, кожный зуд, эритема |
|
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
Костно-мышечные боль и дискомфорт |
Остеопороз/остеопения, артралгия, мышечная слабость, спазмы мышц, припухлость и скованность суставов |
Рабдомиолиз |
|
Нарушения со стороны почек и мочевыводящих путей |
|
|
Учащенное мочеиспускание, императивные позывы на мочеиспускание, дизурия, ноктурия, почечная недостаточность, недержание мочи |
|
|
Нарушения со стороны репродуктивной системы и грудных желез |
|
Гинекомастия*, атрофия яичек*, эректильная дисфункция* |
Болезненность яичек, болезненность грудных желез, тазовая боль, раздражение гениталий, расстройство семяизвержения |
|
|
Общие нарушения и реакции в месте введения |
Реакции в месте введения |
Озноб, лихорадка, повышенная утомляемость*, гриппоподобный синдром |
Чувство недомогания, периферические отеки |
|
* Реакции, связанные с подавлением выработки Т
Описание отдельных нежелательных реакций
Изменение лабораторных данных
Изменения лабораторных показателей были сопоставимы в группах, получавших дегареликс и препарат сравнения - агонист ГнРГ (лейпрорелин) в течение одного года в рамках подтверждающего клинического исследования Фазы III (N=409). При применении указанных препаратов повышение активности (более чем в 3 раза превышающее верхнюю границу нормы (ВГН) «печеночных» трансаминаз (АЛТ, АСТ и гамма-глутамилтранспептидазы (ГГТ) наблюдалось у 2–6 % пациентов, у которых до начала лечения данный показатель был в пределах нормы. Изменения наблюдались после применения каждого препарата. Существенное снижение гематологических показателей, гематокрита (≤ 0,37) и гемоглобина (≤ 115 г/л), наблюдалось у 40 % и 13–15 %, соответственно, пациентов, у которых данные показатели были в норме до начала лечения. Изменения наблюдались после применения каждого препарата. Данные о степени влияния рака предстательной железы и проведения антиандрогенной терапии на снижение указанных выше показателей отсутствуют. Было отмечено повышение концентрации калия (≥ 5,8 ммоль/л), креатинина (≥ 177 мкмоль/л) и азота мочевины крови (≥ 10,7 ммоль/л) у пациентов с нормальными значениями указанных показателей до начала лечения в 6 %, 2 % и 15 % случаев применения дегареликса и 3 %, 2 % и 14 % случаев применения лейпрорелина, соответственно.
Изменение ЭКГ
Изменения ЭКГ были сопоставимы в группах, получавших дегареликс и препарат сравнения лейпрорелин в течение одного года в рамках подтверждающего клинического исследования фазы III (N=409). У 3-х (< 1 %) из 409 пациентов в группе дегареликса и 4-х (2 %) из 201 пациентов в группе лейпрорелина интервал QT с корректировкой Фридериция составил ≥ 500 мс. От начала до завершения исследования медианное изменение интервала QT с корректировкой Фридериция составило в группе дегареликса 12,0 мс, а группе лейпрорелина – 16,7 мс.
Отсутствие влияния собственно дегареликса на сердечную реполяризацию (интервал QT с корректировкой Фридериция), частоту сердечных сокращений, АВ-проводимость, сердечную деполяризацию, морфологию T- или U-волн было подтверждено в ходе тщательного QT-исследования у здоровых добровольцев (N=80), которые получали дегареликс в виде внутривенной инфузии в течение 60 мин, с достижением среднего значения максимальной концентрации (Cmax) 222 нг/мл, что примерно в 3-4 раза больше значения Cmax, полученного при лечении рака предстательной железы.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1 Федеральная служба по надзору в сфере здравоохранения Российской Федерации Телефон: +7 (495) 698–45–38, +7 (499) 578–02–20 Электронная почта: pharm@roszdravnadzor.gov.ru |
4.9. Передозировка
Симптомы
Данные о симптомах острой передозировки дегареликса отсутствуют.
Лечение
В случае передозировки следует наблюдать за пациентом и, при необходимости, применять поддерживающую терапию.
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: противоопухолевые гормональные препараты и антагонисты гормонов; антагонисты гормонов и родственные соединения; другие антагонисты гормонов и родственные соединения.
Код АТХ: L02BX02.
Механизм действия
Дегареликс является селективным антагонистом ГнРГ, способным конкурентно и обратимо связывать гипофизарные ГнРГ-рецепторы, быстро снижая высвобождение гонадотропинов – лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Таким образом, снижается секреция Т в яичках. Рак предстательной железы является гормонозависимой опухолью и поддается лечению, направленному на снижение выработки андрогенов. В отличие от агонистов ГнРГ, антагонисты ГнРГ не индуцируют выброс ЛГ с последующей активацией выброса Т, развитием опухоли и возможным симптоматическим обострением после начала лечения.
Однократное введение дегареликса в дозе 240 мг и последующая поддерживающая терапия в дозе 80 мг, вводимой 1 раз в месяц, быстро снижает концентрацию ЛГ, ФСГ и, как следствие, концентрацию Т. Концентрация дигидротестостерона (ДГТ) в сыворотке крови снижается сходным со снижением концентрации Т образом.
При введении дегареликса наблюдается снижение концентрации Т и поддержание ее на более низком уровне, чем при кастрации (0,5 нг/мл). Терапия дегареликсом в дозе 80 мг 1 раз в месяц приводила к продолжительному подавлению Т у 97 % пациентов в течение, по меньшей мере, одного года. Повторное введение дегареликса не вызывает резкого увеличения выработки тестостерона. Средняя концентрация Т после лечения в течение одного года была равна 0,087 нг/мл (интерквартильный размах 0,06–0,15, N=167).
Клиническая эффективность и безопасность
Результаты подтверждающего клинического исследования Фазы III
Исследование эффективности и безопасности дегареликса проводилось в рамках открытого многоцентрового рандомизированного клинического исследования в параллельных группах с использованием препарата сравнения. Проводилось исследование эффективности и безопасности дегареликса у пациентов с диагностированным раком предстательной железы, нуждающихся в антиандрогенной терапии, при применении 1 раз в месяц в двух разных режимах дозирования: в начальной дозе 240 мг (40 мг/мл) подкожно с последующим введением 160 мг (40 мг/мл) или 80 мг (20 мг/мл) подкожно в сравнении с внутримышечным введением лейпрорелина в дозе 7,5 мг. 620 пациентов были рандомизированы в 3 группы, 504 (81 %) из которых завершили исследование. В группе, получавшей дегареликс в дозе 240 мг/80 мг, 41 пациент (20 %) прекратил участие в исследовании, а в группе, получавшей лейпрорелин, выбыли из исследования 32 пациента (16 %).
Из 610 пациентов, получавших лечение у:
Исходные демографические характеристики групп были одинаковыми. Средний возраст составлял 74 года (от 47 до 98 лет). Основной целью исследования было доказательство эффективности дегареликса в отношении снижения концентрации Т ниже 0,5 нг/мл в течение 12 месяцев лечения.
Была выбрана наименьшая эффективная поддерживающая доза дегареликса 80 мг.
Сохранение концентрации T ≤ 0,5 нг/мл в сыворотке крови
Результаты исследования показали, что препарат Фирмагон позволяет быстро снизить концентрацию Т.
Доля пациентов с концентрацией T < 0,5 нг/мл после начала лечения
|
Время |
Дегареликс, 240 мг/80 мг |
Лейпрорелин, 7,5 мг |
|
День 1 |
52 % |
0 % |
|
День 3 |
96 % |
0 % |
|
День 7 |
99 % |
1 % |
|
День 14 |
100 % |
18 % |
|
День 28 |
100 % |
100 % |
Предотвращение выброса Т
Выброс определяется как рост концентрации Т на ≥ 15 % от исходного значения в течение первых 2-х недель.
В группе пациентов, получавших дегареликс, не было выброса Т. В среднем, концентрация Т понижалась на 94 % на 3-й день. В группе пациентов, получавших лейпрорелин, был зафиксирован выброс Т, в среднем, концентрация Т на фоне терапии лейпрорелином повышалась на 65 % на 3-й день, что подтверждалось статистически значимыми различиями (p < 0,001).
Изменение концентрации Т (в %) от исходного значения по группам терапии до 28 дней (медиана с интерквартильным размахом)
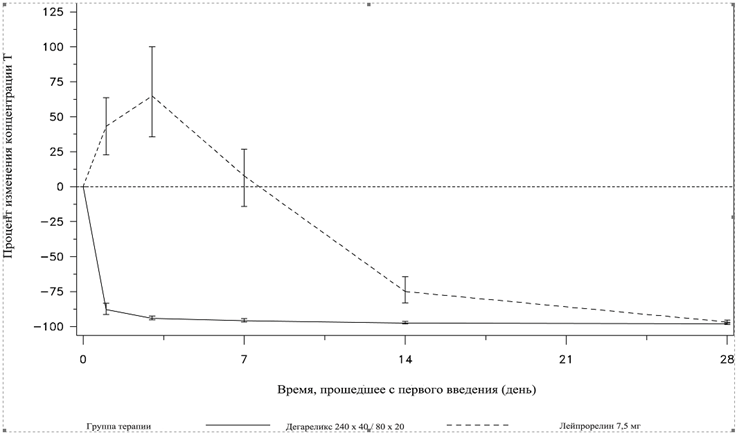
Первичной конечной точкой исследования было снижение концентрации Т через 1 год после начала лечения дегареликсом и лейпрорелином. Клиническое преимущество дегареликса над лейпрорелином в комбинации с антиандрогенной терапией в начальной фазе лечения в отношении первичной цели исследования – снижения уровня Т, показано не было.
Восстановление концентрации Т
Пациентам с растущей концентрацией ПСА после локальной терапии (в основном, радикальной простатэктомии и лучевой терапии) вводился препарат Фирмагон в течение 7 месяцев с последующим периодом наблюдения 7 месяцев. Медианное время восстановления концентрации Т (> 0,5 нг/мл, выше кастрационного уровня) после прекращения введения препарата составило 112 суток (с начала периода наблюдения, т.е. 28 дней после последней инъекции). Медианное время роста концентрации Т до > 1,5 нг/мл (выше нижней границы нормального интервала) составило 168 дней.
Долговременное воздействие
Успешный ответ в исследовании был определен как достижение концентрации Т уровня медицинской кастрации на 28-й день и поддержание ее в течение 364 дней (в течение всего срока концентрация Т не поднималась выше 0,5 нг/мл).
Вероятность кумуляции Т ≤ 0,5 нг/мл на 28 день – 364 день.
|
|
Дегареликс 240 мг/80 мг |
Лейпрорелин 7,5 мг |
|
Количество респондентов |
202 |
194 |
|
Уровень реакции (доверительный интервал)* |
97,2 % |
96,4 % |
* расчет в группах по методу Каплан-Мейера
Снижение концентрации ПСА
Непосредственных измерений размера опухоли в ходе программы клинических исследований не производилось, тем не менее косвенные показатели положительной динамики опухоли включали 95 % медианное снижение концентрации ПСА через 12 месяцев применения дегареликса.
Медианная концентрация ПСА в исследовании составила до начала исследования:
Изменение концентрации ПСА (в %) от включения в исследование по группам терапии до 56 дней (медиана с интерквартильным размахом)
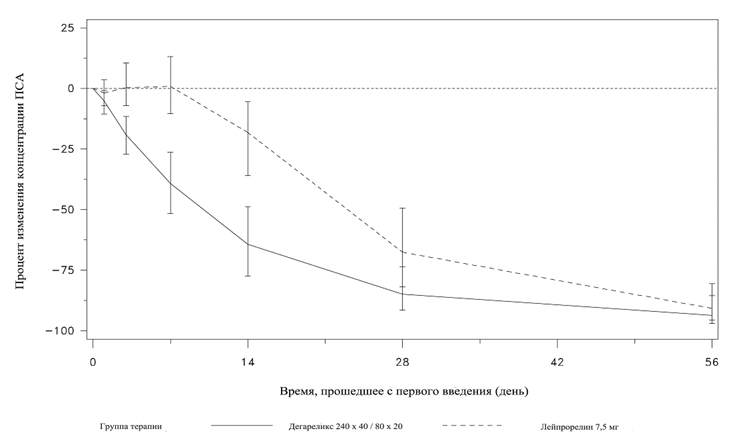
Была получена статистически значимая разница (p < 0,001) показателей по предусмотренным переменным на 14 и 28 день.
Концентрация ПСА снизилась на 64 % через 2 недели после начала применения дегареликса, на 85 % – через 1 месяц, на 95 % – через 3 месяца и оставалась на низком уровне (примерно 97 %) в течение 1 года лечения.
Начиная с 56 дня до 364 дня не было выявлено существенных различий в величине снижения концентрации ПСА относительно исходного показателя в группах применения дегареликса и препарата сравнения лейпрорелина.
Изменение объема предстательной железы
У пациентов, которым показана гормональная терапия перед проведением лучевой терапии, или у пациентов с необходимостью проведения кастрации после 3-х месяцев применения препарата Фирмагон в дозе 240 мг/80 мг объем предстательной железы был уменьшен на 37 % по результатам трансректального ультразвукового исследования (ТРУЗИ). Уменьшение объема предстательной железы в результате лечения дегареликсом было сопоставимо с эффектом применения гозерелина в сочетании с антиандрогенными препаратами.
Влияние на QT/QTc интервал
В клиническом исследовании проводилось сравнение периодически снимаемых электрокардиограмм (ЭКГ) у пациентов, получавших дегареликс и лейпрорелин. Приблизительно у 20 % пациентов в обеих группах были зафиксированы случаи удлинения интервалов QT/QTc выше 450 мс. От включения до окончания исследования медиана изменения интервала в группе применения препарата Фирмагон составила 12,0 мс, в группе лейпрорелина – 16,7 мс.
Выработка антител при применении дегареликса
Выработка антител к дегареликсу наблюдалась у 10 % пациентов после 1 года лечения и у 29 % пациентов, получавших дегареликс в течение 5,5 лет. Нет данных о влиянии образующихся антител на эффективность или безопасность лечения препаратом Фирмагон в результате применения в течение 5,5 лет.
5.2. Фармакокинетические свойства
Абсорбция
После подкожного введения дегареликса в дозе 240 мг (концентрация 40 мг/мл) пациентам с диагностированным раком предстательной железы в клиническом исследовании CS21 площадь под фармакокинетической кривой «концентрация-время» (AUС0–28) составила 635 (602–668) нг/мл*день, Сmax – 66,0 (61,0–71,0) нг/мл, время достижения максимальной концентрации (tmax) – 40 (37–42) ч. Средние значения составляли 11–12 нг/мл после начальной дозы (240 мг) и 11–16 нг/мл после введения поддерживающей дозы (80 мг) при концентрации 20 мг/мл. Снижение Сmax дегареликса в плазме носит двухфазный характер, таким образом, средний конечный период полувыведения (t½) для поддерживающей дозы составляет 29 дней. Длительный t½ после подкожного введения является следствием медленного высвобождения дегареликса из депо, образованных в месте (-ах) инъекции. Фармакокинетика препарата зависит от концентрации раствора при введении. Так, Сmax и биодоступность уменьшаются с повышением концентрации дегареликса, в то время как средний конечный t½ возрастает. Таким образом, не следует вводить препарат в дозах выше рекомендованных.
Распределение
Объем распределения у здоровых пожилых мужчин составляет приблизительно 1 л/кг. Связь с белками плазмы составляет примерно 90 %.
Биотрансформация
Дегареликс подвергается простой пептидной деградации при прохождении через гепатобилиарную систему и в основном выводится в виде пептидов с калом. Значимые метаболиты в плазме крови после подкожного введения не обнаружены. Исследования in vitro показали, что дегареликс не является субстратом системы цитохрома P450 человека.
Элиминация
У здоровых добровольцев после однократного внутривенного введения примерно 20–30 % дозы выводится почками, 70–80 % – через гепатобилиарную систему. Клиренс дегареликса при однократном внутривенном введении в дозах 0,864–49,4 мкг/кг здоровым пожилым мужчинам составил 35–50 мл/ч/кг.
Фармакокинетика в особых клинических случаях
Пациенты с нарушениями функции почек
Фармакокинетические исследования применения дегареликса у пациентов с нарушениями функции почек не проводились. Только около 20–30 % препарата в неизмененном виде выводится почками. Анализ данных популяционной фармакокинетики, полученных при проведении подтверждающего клинического исследования Фазы III, показал, что клиренс дегареликса у пациентов с нарушениями функции почек легкой или средней степени снижается примерно на 23 %. Таким образом, коррекция дозы при применении препарата Фирмагон у пациентов с нарушениями функции почек легкой или средней степени не требуется. В связи с ограниченностью данных применять препарат Фирмагон у пациентов с нарушениями функции почек тяжелой степени тяжести следует с осторожностью.
Пациенты с нарушением функции печени
В ходе клинических исследований проводилось исследование фармакокинетики дегареликса у пациентов с нарушением функции печени легкой и средней степени тяжести. Признаков увеличения экспозиции у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами не выявлено. Таким образом, установлено, что коррекция дозы у пациентов с нарушением функции печени легкой или средней степени тяжести не требуется. В связи с ограниченностью данных применять препарат Фирмагон у пациентов с нарушениями функции печени тяжелой степени тяжести следует с осторожностью.
5.3. Данные доклинической безопасности
В исследованиях репродуктивной токсичности у животных было показано, что применение дегареликса приводит к бесплодию у самцов. Развитие бесплодия было обусловлено фармакологическим действием препарата и носило обратимый характер.
Результаты исследований репродуктивной токсичности дегареликса у самок соответствуют его фармакологическому действию. Препарат вызывал дозозависимое удлинение периода наступления спаривания и оплодотворения, а также снижение числа желтых тел, увеличение частоты пре- и постимплантационной гибели эмбрионов, выкидышей, ранней эмбриофетальной гибели, преждевременных родов и длительности родов.
В доклинических данных, полученных по результатам исследований фармакологической безопасности, токсичности при многократном введении, генотоксичности и канцерогенного потенциала, особый вред для человека не выявлен. В исследованиях in vitro и in vivo не выявлено удлинение интервала QT.
В исследованиях острой, субхронической и хронической токсичности после подкожного введения дегареликса не выявлено признаков поражения внутренних органов у крыс и обезьян. Местнораздражающее действие было выявлено у подопытных животных при подкожном введении высоких доз дегареликса.
6.1. Перечень вспомогательных веществ
Лиофилизат:
Маннитол.
Растворитель:
Вода для инъекций.
6.2. Несовместимость
Данный лекарственный препарат не следует смешивать с другими лекарственными препаратами, за исключением упомянутых в разделе 6.6.
6.3. Срок годности (срок хранения)
Лиофилизат: 3 года.
Растворитель: 3 года.
6.4. Особые меры предосторожности при хранении
Хранить при температуре не выше 25 °С.
6.5. Характер и содержание первичной упаковки
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
По 80 мг дегареликса во флакон бесцветного стекла типа I, укупоренный бромбутиловой пробкой с алюминиевой обкаткой и пластиковым колпачком типа «флип-офф».
По 4,2 мл воды для инъекций в одноразовом шприце бесцветного стекла типа I, с бромбутиловым уплотнителем на поршне, с наконечником из бутадиен-стиролового каучука типа II. Шприц может находиться в упаковке в собранном или разобранном виде (шток поршня отдельно).
По 1 флакону с лиофилизатом, 1 шприцу с растворителем, 1 переходнику и 1 игле для инъекций (все компоненты помещаются в пластиковый поддон) вместе с инструкцией по применению в картонную пачку.
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
По 120 мг дегареликса во флакон бесцветного стекла типа I, укупоренный бромбутиловой пробкой с алюминиевой обкаткой и пластиковым колпачком типа «флип-офф».
По 3,0 мл воды для инъекций в одноразовом шприце бесцветного стекла типа I, с бромбутиловым уплотнителем на поршне, с наконечником из бутадиен-стиролового каучука типа II. Шприц может находиться в упаковке в собранном или разобранном виде (шток поршня отдельно).
По 2 флакона с лиофилизатом, 2 шприца с растворителем, 2 переходника и 2 иглы для инъекций (все компоненты помещаются в пластиковые поддоны) вместе с инструкцией по применению в картонную пачку.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Рекомендации по приготовлению раствора и выполнению инъекции
Приготовление восстановленного раствора в других концентрациях не допустимо, поскольку повышение концентрации дегареликса в растворе может привести к гелеобразованию. Восстановленный раствор представляет собой прозрачный бесцветный раствор.
Не следует встряхивать флаконы с лиофилизатом при добавлении растворителя.
|
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
|
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
|
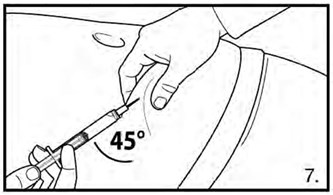
|
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения Медленно ввести 4 мл раствора сразу после приготовления. |
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения Медленно ввести 3 мл раствора сразу после приготовления. |
Не вводить препарат внутривенно. Убедиться, что кровь не попала в шприц с препаратом. При попадании крови в шприц препарат использовать нельзя. В этом случае необходимо прервать процедуру и приготовить новую дозу препарата!
Приготовить вторую дозу, как описано выше. Выбрать новое место для инъекции и ввести еще 3 мл раствора препарата.
Рекомендуется использовать только свежеприготовленный раствор!
Препарат Фирмагон нельзя смешивать с другими лекарственными средствами в одном шприце!
Нет особых требований к утилизации.
Дания
Ферринг Фармасьютикалс А/С
Кай Фискерс Пладс 11, Копенгаген С, 2300.
Телефон: +45 88 33 88 34.
Факс: +45 88 33 88 80.
Электронная почта: production@ferring.com
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб, д. 52, стр. 4.
Тел: (495) 287–0343.
Факс: (495) 287–0342.
Электронная почта: SafetyMailboxRussia@ferring.com
ЛП-№(000278)-(РГ-RU)
Дата первой регистрации: 16.06.2021
Общая характеристика лекарственного препарата Фирмагон доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» https://eec.eaeunion.org/.