Онкология
-
ФИРМАГОН
ФИРМАГОН
(дегареликс)
(дегареликс)
Онкология - НАИМЕНОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
- КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ СОСТАВ
- ЛЕКАРСТВЕННАЯ ФОРМА
- КЛИНИЧЕСКИЕ ДАННЫЕ
- ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
- 31 % был диагностирован локализованный рак предстательной железы;
- 29 % – местно распространенный рак предстательной железы;
- 20 % – метастатический рак предстательной железы;
- 7 % – неустановленный метастатический статус;
- у 13 % пациентов повышение ПСА отмечалось после выполнения радикального хирургического вмешательства или лучевой терапии.
- для группы, получавшей дегареликс 240 мг/80 мг: 19,8 нг/мл (интерквартильный размах P25 9,4 нг/мл, P75 46,4 нг/мл);
- для группы, получавшей лейпрорелин 7,5 мг: 17,4 нг/мл (интерквартильный размах P25 8,4 нг/мл, P75 56,5 нг/мл).
- ФАРМАЦЕВТИЧЕСКИЕ СВОЙСТВА
- Снять защитный колпачок с флакона с лиофилизатом. Плотно надеть переходник на флакон, острый конец переходника должен проколоть резиновую пробку флакона, зафиксировав переходник.
- Приготовить предварительно заполненный шприц с растворителем, присоединив шток поршня.
- Снять защитный колпачок со шприца с растворителем. Присоединить шприц к флакону с лиофилизатом путем навинчивания на переходник. Медленно ввести весь объем растворителя во флакон.
- Не снимая шприц с переходника, круговыми движениями аккуратно перемешать содержимое флакона до получения прозрачного раствора. Наличие нерастворенных частиц не допускается. При наличии на стенках флакона нерастворенных частиц лиофилизата флакон можно слегка наклонить. Не взбалтывать во избежание пенообразования. Допустимо образование небольших пузырьков воздуха на поверхности жидкости. Растворение обычно происходит за несколько минут, в некоторых случаях требуется до 15 минут.
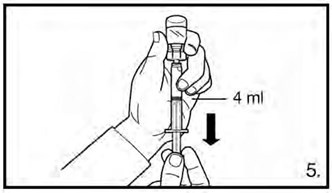
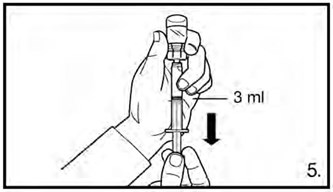
- Перевернуть флакон и набрать 3 мл раствора для дозировки 120 мг или 4 мл раствора для дозировки 80 мг до отметки на шприце. Перед инъекцией необходимо удостовериться, что отобран точный объем раствора и что в препарате отсутствуют пузырьки воздуха.
- Отсоединить шприц от переходника и надеть на шприц иглу для инъекции.
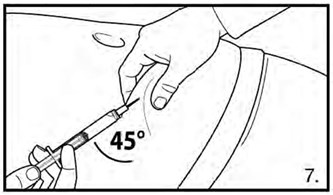
- Выполнить подкожную инъекцию: обхватить и приподнять кожу на животе и ввести иглу под углом не менее 45° глубоко в кожную складку, медленно ввести раствор.
- Не рекомендуется вводить препарат в области, подвергающиеся давлению (например, области ношения ремня или пояса, область ребер).
- Только для препарата Фирмагон, лиофилизат для приготовления раствора для подкожного введения, 120 мг
- ДЕРЖАТЕЛЬ РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- НОМЕР РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
- ДАТА ПЕРВИЧНОЙ РЕГИСТРАЦИИ (ПОДТВЕРЖДЕНИЯ РЕГИСТРАЦИИ, ПЕРЕРЕГИСТРАЦИИ)
- ДАТА ПЕРЕСМОТРА ТЕКСТА
ФИРМАГОН (дегареликс)
ОБЩАЯ ХАРАКТЕРИСТИКА ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
Действующее вещество: дегареликс.
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения Каждый флакон содержит 80 мг дегареликса (в виде ацетата).
1 мл восстановленного раствора содержит 20 мг дегареликса.
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
Каждый флакон содержит 120 мг дегареликса (в виде ацетата).
1 мл восстановленного раствора содержит 40 мг дегареликса.
Полный перечень вспомогательных веществ приведен в разделе 6.1.
Лиофилизат для приготовления раствора для подкожного введения.
Лиофилизат: белая или почти белая лиофилизированная масса.
Растворитель: прозрачная бесцветная жидкость.
4.1. Показания к применению
Препарат Фирмагон показан для терапии распространенного гормонозависимого рака предстательной железы у взрослых мужчин.
4.2. Режим дозирования и способ применения
Режим дозирования
|
Начальная доза |
Поддерживающая доза – ежемесячно |
|
240 мг, вводится однократно подкожно в виде 2-х инъекций по 120 мг |
80 мг, вводится подкожно в виде 1 инъекции |
Первое введение поддерживающей дозы проводится через 1 месяц после введения начальной дозы.
Терапевтический эффект препарата Фирмагон следует отслеживать по клиническим параметрам и концентрации простатспецифического антигена (ПСА) в сыворотке крови. Подавление выработки тестостерона (Т) происходит сразу же после введения начальной дозы, при этом концентрация Т в сыворотке крови падает до кастрационного уровня (Т ≤ 0,5 нг/мл) у 96 % пациентов через 3 дня, у 100 % пациентов – через 1 месяц. Длительная, до 1 года, поддерживающая терапия обеспечивает подавление выработки Т ≤ 0,5 нг/мл у 97 % пациентов.
Если у пациента терапевтический эффект выражен недостаточно, следует удостовериться, что концентрация Т в сыворотке крови остается сниженной в достаточной степени.
Препарат Фирмагон не вызывает колебаний концентрации Т, поэтому нет необходимости принимать антиандрогенные препараты в начале лечения.
Особые группы пациентов
Пожилые пациенты, пациенты с нарушением функции почек или печени
У пожилых пациентов, при нарушениях функции почек или печени легкой и средней степени отсутствует необходимость в коррекции дозы препарата (см. раздел 5.2). Данные по применению дегареликса у пациентов с тяжелыми нарушениями функции почек или печени отсутствуют, препарат следует применять с осторожностью (см. раздел 4.4).
Дети
Препарат Фирмагон не предназначен для применения у детей и подростков до 18 лет.
Способ применения
Подкожно. Не вводить внутривенно! Эффективность и безопасность внутримышечного введения препарата Фирмагон не изучались.
Инъекции проводятся подкожно в область живота. Место инъекций необходимо периодически менять. Необходимо избегать мест, которые подвергаются давлению (например, около пояса или ремня и около ребер).
Инструкции по приготовлению раствора лекарственного препарата перед применением и выполнению инъекции см. в разделе 6.6.
4.3. Противопоказания
Гиперчувствительность к дегареликсу или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
4.4. Особые указания и меры предосторожности при применении
Влияние на QT/QTc интервал
Длительная супрессия андрогенных гормонов может вызвать удлинение интервала QT. В ходе подтверждающего клинического исследования проводилось сравнение ежемесячно снимаемых электрокардиограмм (ЭКГ) у пациентов, получавших препарат Фирмагон и лейпрорелин. У 20 % пациентов в обеих группах было выявлено удлинение интервала QT/QTc выше 450 мс; у 1 % пациентов, получавших дегареликс, и у 2 % пациентов, получавших лейпрорелин, было установлено удлинение интервала QT/QTc до 500 мс (см. раздел 5.1).
Не проводилось исследование применения препарата Фирмагон у пациентов с удлинением интервала QT свыше 450 мс в анамнезе, у пациентов с наличием или риском развития полиморфной желудочковой тахикардии типа «пируэт», а также у пациентов, одновременно принимающих лекарственные препараты, приводящие к удлинению интервала QT. Таким образом, необходимо оценить отношение ожидаемой пользы к возможному риску применения препарата Фирмагон в указанных случаях (см. разделы 4.5 и 4.8).
В ходе исследований не было выявлено непосредственного влияния дегареликса на интервал QT/QTc (см. раздел 4.8).
Нарушение функции печени
Пациенты с диагностированным или предполагаемым нарушением функции печени не включались в клинические исследования дегареликса. При применении препарата отмечалось незначительное преходящее повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). Концентрация билирубина не повышалась, не наблюдалось проявлений клинических симптомов нарушения функции печени. В ходе применения препарата рекомендуется контролировать показатели функции печени у пациентов с диагностированным или предполагаемым нарушением функции печени. Фармакокинетика дегареликса после однократного внутривенного введения изучалась у пациентов с нарушениями функции печени легкой или средней степени тяжести (см. раздел 5.2).
Нарушение функции почек
Исследования применения дегареликса у пациентов с почечной недостаточностью тяжелой степени не проводились. Таким образом, у данной категории пациентов препарат следует применять с осторожностью.
Реакции гиперчувствительности
Исследования применения дегареликса у пациентов с наличием в анамнезе тяжелой бронхиальной астмы, анафилактическими реакциями, тяжелой формой крапивницы или ангионевротических отеков не проводились.
Изменение минеральной плотности костной ткани
Изменение минеральной плотности костной ткани (МПКТ) при применении дегареликса не изучалось, однако в медицинской литературе сообщалось, что у пациентов, перенесших орхиэктомию или принимавших агонисты гонадотропин-рилизинг гормона (ГнРГ), наблюдается снижение МПКТ. Поэтому вследствие длительного подавления выделения Т, вызванного применением препарата Фирмагон, возможно снижение МПКТ.
Толерантность к глюкозе
Влияние дегареликса на концентрацию инсулина и глюкозы в крови не изучалось. Однако у пациентов, перенесших орхиэктомию или принимавших агонисты ГнРГ, наблюдается снижение толерантности к глюкозе и возможно развитие или декомпенсация сахарного диабета. Поэтому при применении антиандрогенной терапии рекомендуется более частый контроль концентрации глюкозы в крови.
Заболевания сердечно-сосудистой системы
Имеются сообщения о возможности развития сердечно-сосудистых заболеваний, включая инсульт и инфаркт миокарда, у пациентов, получающих антиандрогенную терапию. Таким образом, при назначении препарата, следует учитывать риск развития заболеваний сердечно-сосудистой системы.
4.5. Взаимодействие с другими лекарственными препаратами и другие виды взаимодействия
Специальное исследование лекарственных взаимодействий не проводилось.
Поскольку при антиандрогенной терапии возможно удлинение интервала QTc, следует оценить необходимость одновременного применения дегареликса с препаратами, которые вызывают удлинение интервала QTc или желудочковую тахикардию типа «пируэт», например, антиаритмическими препаратами IA класса (хинидин, дизопирамид); антиаритмическими препаратами III класса (например, амиодарон, соталол, дофетилид, ибутилид), а также метадоном и моксифлоксацином, антипсихотическими средствами (нейролептиками) и другими лекарственными препаратами (см. раздел 4.4).
Клинически значимое фармакокинетическое взаимодействие дегареликса и лекарственных средств, в метаболизме которых принимает участие система цитохрома Р450, маловероятно, поскольку исследования in vitro показали, что дегареликс не является субстратом системы цитохрома Р450 и не ингибирует или индуцирует изоферменты CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5.
4.6. Фертильность, беременность и лактация
Беременность и лактация
Препарат Фирмагон не предназначен для применения у женщин.
Фертильность
Препарат Фирмагон может оказывать угнетающее воздействие на фертильность у мужчин за счет подавления выработки Т.
4.7. Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Фирмагон не оказывает или оказывает незначительное влияние на способность управлять транспортным средством и работать с механизмами. Нежелательные реакции, такие как повышенная утомляемость и головокружение, развивающиеся при применении препарата, могут влиять на способность управления транспортными средствами и работы с механизмами.
4.8. Нежелательные реакции
Резюме профиля безопасности
Наиболее частые нежелательные реакции (НР), наблюдаемые при применении дегареликса в ходе подтверждающего клинического исследования Фазы III (N = 409), были обусловлены физиологическим эффектом подавления выработки Т, включая такие НР, как приливы крови к лицу и увеличение массы тела (у 25 % и 7 % пациентов, получавших препарат в течение 1 года, соответственно) или реакции в месте введения. Озноб, повышение температуры тела или гриппоподобный синдром наблюдались в течение нескольких часов после введения препарата (у 3 %, 2 % и 1 % пациентов, соответственно).
НР в месте введения, в основном, проявляются в форме боли и покраснения (у 28 % и 17 % пациентов, соответственно), реже наблюдались такие НР как отек (6 %), уплотнение (4 %) и образование узелков (3 %). Такие реакции, в основном, наблюдаются при введении начальной дозы, тем временем, в ходе поддерживающей терапии (80 мг) частота таких проявлений на 100 инъекций составила 3 случая боли в месте введения и < 1 – покраснения, отека, образования узелков и уплотнения. Большинство указанных НР носили временный характер, были легкой или средней степени тяжести и редко приводили к прекращению терапии (< 1 %). Тяжелые реакции в месте введения, включая инфекцию, абсцесс или некроз в месте инъекции, требующие хирургического вмешательства/дренирования, наблюдались очень редко.
Табличное резюме нежелательных реакций
Частота НР: очень часто (≥ 1/10), часто (≥ 1/100, но < 1/10), нечасто (≥ 1/1000, но < 1/100), редко (≥ 1/10000, но < 1/1000), очень редко (< 1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно). В рамках одной градации частоты НР расположены в порядке убывания их серьезности.
|
Системно-органный класс |
Очень часто |
Часто |
Нечасто |
Редко |
|
Нарушения со стороны крови и лимфатической системы |
|
Анемия* |
|
Фебрильная нейтропения |
|
Нарушения со стороны иммунной системы |
|
|
Гиперчувствительность |
Анафилактические реакции |
|
Нарушения метаболизма и питания |
|
Увеличение массы тела* |
Гипергликемия/сахарный диабет, увеличение концентрации холестерина, снижение массы тела, снижение аппетита, изменение концентрации кальция в плазме крови |
|
|
Психические нарушения |
|
Бессонница |
Депрессия, снижение либидо* |
|
|
Нарушения со стороны нервной системы |
|
Головокружение, головная боль |
Снижение интеллектуальной деятельности, гипестезия |
|
|
Нарушения со стороны органа зрения |
|
|
Нечеткость зрения |
|
|
Нарушения со стороны сердца |
|
|
Аритмия (включая фибрилляцию предсердий), ощущение сердцебиения, удлинение интервала QT* |
Инфаркт миокарда, острая сердечная недостаточность |
|
Нарушения со стороны сосудов |
Приливы крови к лицу* |
|
Артериальная гипертензия, вазовагальные реакции (включая артериальную гипотензию) |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|
|
Одышка |
|
|
Желудочно-кишечные нарушения |
|
Диарея, тошнота |
Запор, рвота, боль в животе, дискомфорт в брюшной полости, сухость во рту |
|
|
Нарушения со стороны печени и желчевыводящих путей |
|
Повышение активности «печеночных» трансаминаз |
Повышение концентрации билирубина, повышение активности щелочной фосфатазы |
|
|
Нарушения со стороны кожи и подкожных тканей |
|
Повышенное потоотделение (включая ночное)*, кожная сыпь |
Крапивница, образование узелков, алопеция, кожный зуд, эритема |
|
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
|
Костно-мышечные боль и дискомфорт |
Остеопороз/остеопения, артралгия, мышечная слабость, спазмы мышц, припухлость и скованность суставов |
Рабдомиолиз |
|
Нарушения со стороны почек и мочевыводящих путей |
|
|
Учащенное мочеиспускание, императивные позывы на мочеиспускание, дизурия, ноктурия, почечная недостаточность, недержание мочи |
|
|
Нарушения со стороны репродуктивной системы и грудных желез |
|
Гинекомастия*, атрофия яичек*, эректильная дисфункция* |
Болезненность яичек, болезненность грудных желез, тазовая боль, раздражение гениталий, расстройство семяизвержения |
|
|
Общие нарушения и реакции в месте введения |
Реакции в месте введения |
Озноб, лихорадка, повышенная утомляемость*, гриппоподобный синдром |
Чувство недомогания, периферические отеки |
|
* Реакции, связанные с подавлением выработки Т
Описание отдельных нежелательных реакций
Изменение лабораторных данных
Изменения лабораторных показателей были сопоставимы в группах, получавших дегареликс и препарат сравнения - агонист ГнРГ (лейпрорелин) в течение одного года в рамках подтверждающего клинического исследования Фазы III (N=409). При применении указанных препаратов повышение активности (более чем в 3 раза превышающее верхнюю границу нормы (ВГН) «печеночных» трансаминаз (АЛТ, АСТ и гамма-глутамилтранспептидазы (ГГТ) наблюдалось у 2–6 % пациентов, у которых до начала лечения данный показатель был в пределах нормы. Изменения наблюдались после применения каждого препарата. Существенное снижение гематологических показателей, гематокрита (≤ 0,37) и гемоглобина (≤ 115 г/л), наблюдалось у 40 % и 13–15 %, соответственно, пациентов, у которых данные показатели были в норме до начала лечения. Изменения наблюдались после применения каждого препарата. Данные о степени влияния рака предстательной железы и проведения антиандрогенной терапии на снижение указанных выше показателей отсутствуют. Было отмечено повышение концентрации калия (≥ 5,8 ммоль/л), креатинина (≥ 177 мкмоль/л) и азота мочевины крови (≥ 10,7 ммоль/л) у пациентов с нормальными значениями указанных показателей до начала лечения в 6 %, 2 % и 15 % случаев применения дегареликса и 3 %, 2 % и 14 % случаев применения лейпрорелина, соответственно.
Изменение ЭКГ
Изменения ЭКГ были сопоставимы в группах, получавших дегареликс и препарат сравнения лейпрорелин в течение одного года в рамках подтверждающего клинического исследования фазы III (N=409). У 3-х (< 1 %) из 409 пациентов в группе дегареликса и 4-х (2 %) из 201 пациентов в группе лейпрорелина интервал QT с корректировкой Фридериция составил ≥ 500 мс. От начала до завершения исследования медианное изменение интервала QT с корректировкой Фридериция составило в группе дегареликса 12,0 мс, а группе лейпрорелина – 16,7 мс.
Отсутствие влияния собственно дегареликса на сердечную реполяризацию (интервал QT с корректировкой Фридериция), частоту сердечных сокращений, АВ-проводимость, сердечную деполяризацию, морфологию T- или U-волн было подтверждено в ходе тщательного QT-исследования у здоровых добровольцев (N=80), которые получали дегареликс в виде внутривенной инфузии в течение 60 мин, с достижением среднего значения максимальной концентрации (Cmax) 222 нг/мл, что примерно в 3-4 раза больше значения Cmax, полученного при лечении рака предстательной железы.
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств – членов Евразийского экономического союза.
|
Российская Федерация Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1 Федеральная служба по надзору в сфере здравоохранения Российской Федерации Телефон: +7 (495) 698–45–38, +7 (499) 578–02–20 Электронная почта: pharm@roszdravnadzor.gov.ru |
4.9. Передозировка
Симптомы
Данные о симптомах острой передозировки дегареликса отсутствуют.
Лечение
В случае передозировки следует наблюдать за пациентом и, при необходимости, применять поддерживающую терапию.
5.1. Фармакодинамические свойства
Фармакотерапевтическая группа: противоопухолевые гормональные препараты и антагонисты гормонов; антагонисты гормонов и родственные соединения; другие антагонисты гормонов и родственные соединения.
Код АТХ: L02BX02.
Механизм действия
Дегареликс является селективным антагонистом ГнРГ, способным конкурентно и обратимо связывать гипофизарные ГнРГ-рецепторы, быстро снижая высвобождение гонадотропинов – лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ). Таким образом, снижается секреция Т в яичках. Рак предстательной железы является гормонозависимой опухолью и поддается лечению, направленному на снижение выработки андрогенов. В отличие от агонистов ГнРГ, антагонисты ГнРГ не индуцируют выброс ЛГ с последующей активацией выброса Т, развитием опухоли и возможным симптоматическим обострением после начала лечения.
Однократное введение дегареликса в дозе 240 мг и последующая поддерживающая терапия в дозе 80 мг, вводимой 1 раз в месяц, быстро снижает концентрацию ЛГ, ФСГ и, как следствие, концентрацию Т. Концентрация дигидротестостерона (ДГТ) в сыворотке крови снижается сходным со снижением концентрации Т образом.
При введении дегареликса наблюдается снижение концентрации Т и поддержание ее на более низком уровне, чем при кастрации (0,5 нг/мл). Терапия дегареликсом в дозе 80 мг 1 раз в месяц приводила к продолжительному подавлению Т у 97 % пациентов в течение, по меньшей мере, одного года. Повторное введение дегареликса не вызывает резкого увеличения выработки тестостерона. Средняя концентрация Т после лечения в течение одного года была равна 0,087 нг/мл (интерквартильный размах 0,06–0,15, N=167).
Клиническая эффективность и безопасность
Результаты подтверждающего клинического исследования Фазы III
Исследование эффективности и безопасности дегареликса проводилось в рамках открытого многоцентрового рандомизированного клинического исследования в параллельных группах с использованием препарата сравнения. Проводилось исследование эффективности и безопасности дегареликса у пациентов с диагностированным раком предстательной железы, нуждающихся в антиандрогенной терапии, при применении 1 раз в месяц в двух разных режимах дозирования: в начальной дозе 240 мг (40 мг/мл) подкожно с последующим введением 160 мг (40 мг/мл) или 80 мг (20 мг/мл) подкожно в сравнении с внутримышечным введением лейпрорелина в дозе 7,5 мг. 620 пациентов были рандомизированы в 3 группы, 504 (81 %) из которых завершили исследование. В группе, получавшей дегареликс в дозе 240 мг/80 мг, 41 пациент (20 %) прекратил участие в исследовании, а в группе, получавшей лейпрорелин, выбыли из исследования 32 пациента (16 %).
Из 610 пациентов, получавших лечение у:
Исходные демографические характеристики групп были одинаковыми. Средний возраст составлял 74 года (от 47 до 98 лет). Основной целью исследования было доказательство эффективности дегареликса в отношении снижения концентрации Т ниже 0,5 нг/мл в течение 12 месяцев лечения.
Была выбрана наименьшая эффективная поддерживающая доза дегареликса 80 мг.
Сохранение концентрации T ≤ 0,5 нг/мл в сыворотке крови
Результаты исследования показали, что препарат Фирмагон позволяет быстро снизить концентрацию Т.
Доля пациентов с концентрацией T < 0,5 нг/мл после начала лечения
|
Время |
Дегареликс, 240 мг/80 мг |
Лейпрорелин, 7,5 мг |
|
День 1 |
52 % |
0 % |
|
День 3 |
96 % |
0 % |
|
День 7 |
99 % |
1 % |
|
День 14 |
100 % |
18 % |
|
День 28 |
100 % |
100 % |
Предотвращение выброса Т
Выброс определяется как рост концентрации Т на ≥ 15 % от исходного значения в течение первых 2-х недель.
В группе пациентов, получавших дегареликс, не было выброса Т. В среднем, концентрация Т понижалась на 94 % на 3-й день. В группе пациентов, получавших лейпрорелин, был зафиксирован выброс Т, в среднем, концентрация Т на фоне терапии лейпрорелином повышалась на 65 % на 3-й день, что подтверждалось статистически значимыми различиями (p < 0,001).
Изменение концентрации Т (в %) от исходного значения по группам терапии до 28 дней (медиана с интерквартильным размахом)
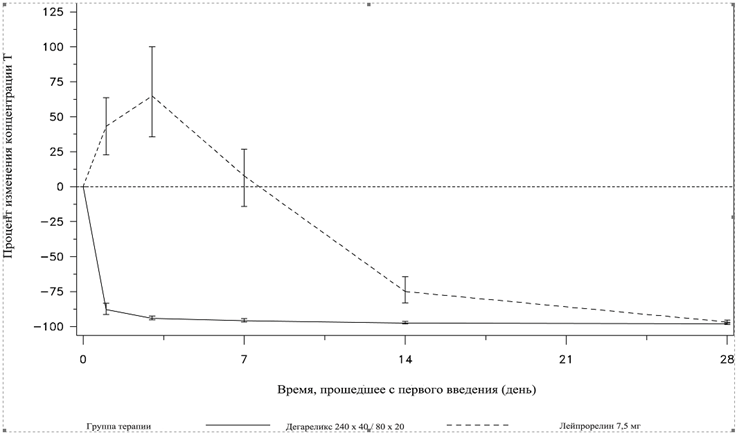
Первичной конечной точкой исследования было снижение концентрации Т через 1 год после начала лечения дегареликсом и лейпрорелином. Клиническое преимущество дегареликса над лейпрорелином в комбинации с антиандрогенной терапией в начальной фазе лечения в отношении первичной цели исследования – снижения уровня Т, показано не было.
Восстановление концентрации Т
Пациентам с растущей концентрацией ПСА после локальной терапии (в основном, радикальной простатэктомии и лучевой терапии) вводился препарат Фирмагон в течение 7 месяцев с последующим периодом наблюдения 7 месяцев. Медианное время восстановления концентрации Т (> 0,5 нг/мл, выше кастрационного уровня) после прекращения введения препарата составило 112 суток (с начала периода наблюдения, т.е. 28 дней после последней инъекции). Медианное время роста концентрации Т до > 1,5 нг/мл (выше нижней границы нормального интервала) составило 168 дней.
Долговременное воздействие
Успешный ответ в исследовании был определен как достижение концентрации Т уровня медицинской кастрации на 28-й день и поддержание ее в течение 364 дней (в течение всего срока концентрация Т не поднималась выше 0,5 нг/мл).
Вероятность кумуляции Т ≤ 0,5 нг/мл на 28 день – 364 день.
|
|
Дегареликс 240 мг/80 мг |
Лейпрорелин 7,5 мг |
|
Количество респондентов |
202 |
194 |
|
Уровень реакции (доверительный интервал)* |
97,2 % |
96,4 % |
* расчет в группах по методу Каплан-Мейера
Снижение концентрации ПСА
Непосредственных измерений размера опухоли в ходе программы клинических исследований не производилось, тем не менее косвенные показатели положительной динамики опухоли включали 95 % медианное снижение концентрации ПСА через 12 месяцев применения дегареликса.
Медианная концентрация ПСА в исследовании составила до начала исследования:
Изменение концентрации ПСА (в %) от включения в исследование по группам терапии до 56 дней (медиана с интерквартильным размахом)
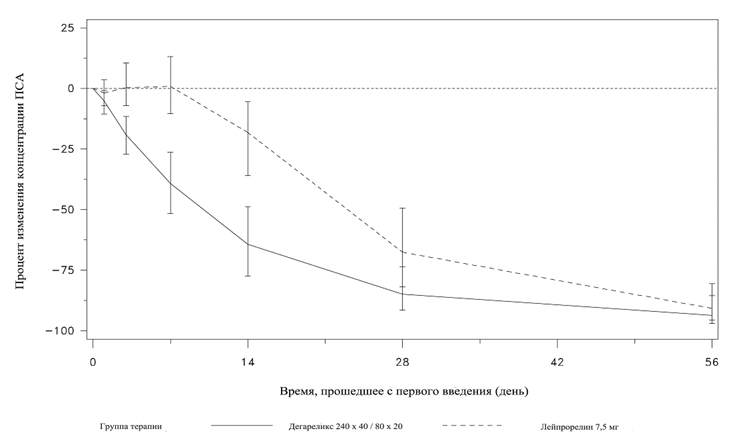
Была получена статистически значимая разница (p < 0,001) показателей по предусмотренным переменным на 14 и 28 день.
Концентрация ПСА снизилась на 64 % через 2 недели после начала применения дегареликса, на 85 % – через 1 месяц, на 95 % – через 3 месяца и оставалась на низком уровне (примерно 97 %) в течение 1 года лечения.
Начиная с 56 дня до 364 дня не было выявлено существенных различий в величине снижения концентрации ПСА относительно исходного показателя в группах применения дегареликса и препарата сравнения лейпрорелина.
Изменение объема предстательной железы
У пациентов, которым показана гормональная терапия перед проведением лучевой терапии, или у пациентов с необходимостью проведения кастрации после 3-х месяцев применения препарата Фирмагон в дозе 240 мг/80 мг объем предстательной железы был уменьшен на 37 % по результатам трансректального ультразвукового исследования (ТРУЗИ). Уменьшение объема предстательной железы в результате лечения дегареликсом было сопоставимо с эффектом применения гозерелина в сочетании с антиандрогенными препаратами.
Влияние на QT/QTc интервал
В клиническом исследовании проводилось сравнение периодически снимаемых электрокардиограмм (ЭКГ) у пациентов, получавших дегареликс и лейпрорелин. Приблизительно у 20 % пациентов в обеих группах были зафиксированы случаи удлинения интервалов QT/QTc выше 450 мс. От включения до окончания исследования медиана изменения интервала в группе применения препарата Фирмагон составила 12,0 мс, в группе лейпрорелина – 16,7 мс.
Выработка антител при применении дегареликса
Выработка антител к дегареликсу наблюдалась у 10 % пациентов после 1 года лечения и у 29 % пациентов, получавших дегареликс в течение 5,5 лет. Нет данных о влиянии образующихся антител на эффективность или безопасность лечения препаратом Фирмагон в результате применения в течение 5,5 лет.
5.2. Фармакокинетические свойства
Абсорбция
После подкожного введения дегареликса в дозе 240 мг (концентрация 40 мг/мл) пациентам с диагностированным раком предстательной железы в клиническом исследовании CS21 площадь под фармакокинетической кривой «концентрация-время» (AUС0–28) составила 635 (602–668) нг/мл*день, Сmax – 66,0 (61,0–71,0) нг/мл, время достижения максимальной концентрации (tmax) – 40 (37–42) ч. Средние значения составляли 11–12 нг/мл после начальной дозы (240 мг) и 11–16 нг/мл после введения поддерживающей дозы (80 мг) при концентрации 20 мг/мл. Снижение Сmax дегареликса в плазме носит двухфазный характер, таким образом, средний конечный период полувыведения (t½) для поддерживающей дозы составляет 29 дней. Длительный t½ после подкожного введения является следствием медленного высвобождения дегареликса из депо, образованных в месте (-ах) инъекции. Фармакокинетика препарата зависит от концентрации раствора при введении. Так, Сmax и биодоступность уменьшаются с повышением концентрации дегареликса, в то время как средний конечный t½ возрастает. Таким образом, не следует вводить препарат в дозах выше рекомендованных.
Распределение
Объем распределения у здоровых пожилых мужчин составляет приблизительно 1 л/кг. Связь с белками плазмы составляет примерно 90 %.
Биотрансформация
Дегареликс подвергается простой пептидной деградации при прохождении через гепатобилиарную систему и в основном выводится в виде пептидов с калом. Значимые метаболиты в плазме крови после подкожного введения не обнаружены. Исследования in vitro показали, что дегареликс не является субстратом системы цитохрома P450 человека.
Элиминация
У здоровых добровольцев после однократного внутривенного введения примерно 20–30 % дозы выводится почками, 70–80 % – через гепатобилиарную систему. Клиренс дегареликса при однократном внутривенном введении в дозах 0,864–49,4 мкг/кг здоровым пожилым мужчинам составил 35–50 мл/ч/кг.
Фармакокинетика в особых клинических случаях
Пациенты с нарушениями функции почек
Фармакокинетические исследования применения дегареликса у пациентов с нарушениями функции почек не проводились. Только около 20–30 % препарата в неизмененном виде выводится почками. Анализ данных популяционной фармакокинетики, полученных при проведении подтверждающего клинического исследования Фазы III, показал, что клиренс дегареликса у пациентов с нарушениями функции почек легкой или средней степени снижается примерно на 23 %. Таким образом, коррекция дозы при применении препарата Фирмагон у пациентов с нарушениями функции почек легкой или средней степени не требуется. В связи с ограниченностью данных применять препарат Фирмагон у пациентов с нарушениями функции почек тяжелой степени тяжести следует с осторожностью.
Пациенты с нарушением функции печени
В ходе клинических исследований проводилось исследование фармакокинетики дегареликса у пациентов с нарушением функции печени легкой и средней степени тяжести. Признаков увеличения экспозиции у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами не выявлено. Таким образом, установлено, что коррекция дозы у пациентов с нарушением функции печени легкой или средней степени тяжести не требуется. В связи с ограниченностью данных применять препарат Фирмагон у пациентов с нарушениями функции печени тяжелой степени тяжести следует с осторожностью.
5.3. Данные доклинической безопасности
В исследованиях репродуктивной токсичности у животных было показано, что применение дегареликса приводит к бесплодию у самцов. Развитие бесплодия было обусловлено фармакологическим действием препарата и носило обратимый характер.
Результаты исследований репродуктивной токсичности дегареликса у самок соответствуют его фармакологическому действию. Препарат вызывал дозозависимое удлинение периода наступления спаривания и оплодотворения, а также снижение числа желтых тел, увеличение частоты пре- и постимплантационной гибели эмбрионов, выкидышей, ранней эмбриофетальной гибели, преждевременных родов и длительности родов.
В доклинических данных, полученных по результатам исследований фармакологической безопасности, токсичности при многократном введении, генотоксичности и канцерогенного потенциала, особый вред для человека не выявлен. В исследованиях in vitro и in vivo не выявлено удлинение интервала QT.
В исследованиях острой, субхронической и хронической токсичности после подкожного введения дегареликса не выявлено признаков поражения внутренних органов у крыс и обезьян. Местнораздражающее действие было выявлено у подопытных животных при подкожном введении высоких доз дегареликса.
6.1. Перечень вспомогательных веществ
Лиофилизат:
Маннитол.
Растворитель:
Вода для инъекций.
6.2. Несовместимость
Данный лекарственный препарат не следует смешивать с другими лекарственными препаратами, за исключением упомянутых в разделе 6.6.
6.3. Срок годности (срок хранения)
Лиофилизат: 3 года.
Растворитель: 3 года.
6.4. Особые меры предосторожности при хранении
Хранить при температуре не выше 25 °С.
6.5. Характер и содержание первичной упаковки
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
По 80 мг дегареликса во флакон бесцветного стекла типа I, укупоренный бромбутиловой пробкой с алюминиевой обкаткой и пластиковым колпачком типа «флип-офф».
По 4,2 мл воды для инъекций в одноразовом шприце бесцветного стекла типа I, с бромбутиловым уплотнителем на поршне, с наконечником из бутадиен-стиролового каучука типа II. Шприц может находиться в упаковке в собранном или разобранном виде (шток поршня отдельно).
По 1 флакону с лиофилизатом, 1 шприцу с растворителем, 1 переходнику и 1 игле для инъекций (все компоненты помещаются в пластиковый поддон) вместе с инструкцией по применению в картонную пачку.
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
По 120 мг дегареликса во флакон бесцветного стекла типа I, укупоренный бромбутиловой пробкой с алюминиевой обкаткой и пластиковым колпачком типа «флип-офф».
По 3,0 мл воды для инъекций в одноразовом шприце бесцветного стекла типа I, с бромбутиловым уплотнителем на поршне, с наконечником из бутадиен-стиролового каучука типа II. Шприц может находиться в упаковке в собранном или разобранном виде (шток поршня отдельно).
По 2 флакона с лиофилизатом, 2 шприца с растворителем, 2 переходника и 2 иглы для инъекций (все компоненты помещаются в пластиковые поддоны) вместе с инструкцией по применению в картонную пачку.
6.6. Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата, и другие манипуляции с препаратом
Рекомендации по приготовлению раствора и выполнению инъекции
Приготовление восстановленного раствора в других концентрациях не допустимо, поскольку повышение концентрации дегареликса в растворе может привести к гелеобразованию. Восстановленный раствор представляет собой прозрачный бесцветный раствор.
Не следует встряхивать флаконы с лиофилизатом при добавлении растворителя.
|
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения
|
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения
|
|
Фирмагон, 80 мг, лиофилизат для приготовления раствора для подкожного введения Медленно ввести 4 мл раствора сразу после приготовления. |
Фирмагон, 120 мг, лиофилизат для приготовления раствора для подкожного введения Медленно ввести 3 мл раствора сразу после приготовления. |
Не вводить препарат внутривенно. Убедиться, что кровь не попала в шприц с препаратом. При попадании крови в шприц препарат использовать нельзя. В этом случае необходимо прервать процедуру и приготовить новую дозу препарата!
Приготовить вторую дозу, как описано выше. Выбрать новое место для инъекции и ввести еще 3 мл раствора препарата.
Рекомендуется использовать только свежеприготовленный раствор!
Препарат Фирмагон нельзя смешивать с другими лекарственными средствами в одном шприце!
Нет особых требований к утилизации.
Дания
Ферринг Фармасьютикалс А/С
Кай Фискерс Пладс 11, Копенгаген С, 2300.
Телефон: +45 88 33 88 34.
Факс: +45 88 33 88 80.
Электронная почта: production@ferring.com
7.1. Представитель держателя регистрационного удостоверения
Претензии потребителей направлять по адресу:
Российская Федерация
ООО «Ферринг Фармасетикалз»
115054, г. Москва, Космодамианская наб, д. 52, стр. 4.
Тел: (495) 287–0343.
Факс: (495) 287–0342.
Электронная почта: SafetyMailboxRussia@ferring.com
ЛП-№(000278)-(РГ-RU)
Дата первой регистрации: 16.06.2021
Общая характеристика лекарственного препарата Фирмагон доступна на информационном портале Евразийского экономического союза в информационно-коммуникационной сети «Интернет» https://eec.eaeunion.org/.